Glucides
Glycosylation
: O-Glycosylation
Glycanes O-mannose et glycanes O-galactose-glucose
- Biochimie
- Chimie organique
- Bioénergétique
- Composition de la matière vivante
- Transport membranaire
- Moteurs moléculaires
- Voies de signalisation
Ces classes d'O-glycosylation sont résumées dans un tableau et vous pouvez les étudier dans : Other Classes of Eukaryotic Glycans (2022).
Glycanes O-mannose
Les glycanes O-mannose représentent jusqu'à un tiers de tous les O-glycanes dans certains tissus de mammifères, y compris le cerveau.
1. L'O-mannosylation diffère d'autres O-glycosylations (Protein O-mannosylation: Conserved from bacteria to humans 2009).
a. Le processus commence dans le réticulum endoplasmique (RE) de la cellule (Chemoenzymatic Assembly of Mammalian O-Mannose Glycans 2018).
- Le donneur du mannose initial est le dolichol-P, alors que dans l'étape 1 de la première phase de la N-glycosylation, le mannose est ajouté par l'UDP-Man.
- Ce transfert peut s'effectuer par de nombreuses O-mannosyltransférases, dont POMT1 et POMT2 qui fonctionnent ensemble.
b. La suite de la synthèse s'effectue dans l'appareil de Golgi pour former les trois classes principales des glycanes O-mannose chez les mammifères.
- La N-acétylglucosaminyltransférase (POMGNT1) ajoute GlcNAc à l'O-mannose.
- D'autres glucides sont rajoutés ensuite par d'autres transférases.
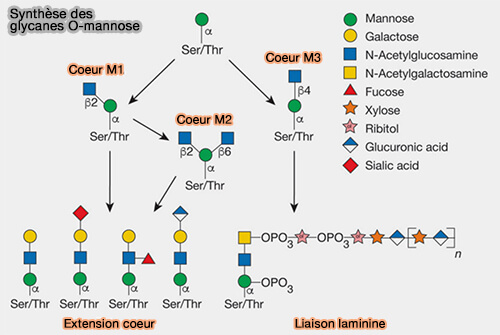
(Figure : vetopsy.fr d'après Varki et coll)
2. L'α-dystroglycane est élaboré à partir du coeur M3 synthétisé, lui, dans le réticulum endoplasmique (RE) et enrichi par la suite par le matriglycane, répétition de Xyl-GlcAc (Other Classes of Eukaryotic Glycans 2022 et Gènes impliqués dans les alpha-dystroglycanopathies 2016).
C'est le principal composant glycoprotéique extracellulaire du complexe dystrophine-glycoprotéine qui provoque de multiples formes de dystrophie musculaire congénitale ou CMD (Congenital Disorders of Glycosylation 2022 et maladies neuromusculaire liées à l'α-dystroglycane).
- Certains mannoses de l'α-dystroglycane servent d'ancres pour des protéines de la matrice extracellulaire (MEC) qui contiennent des laminines (Dystroglycan Function Requires Xylosyl- and Glucuronyltransferase Activities of LARGE 2012).
- La perte de ces glycanes est également associée à des métastases dans de multiples cancers.
Glycanes O-galactose-glucose
Le collagène, ou plutôt les collagènes, fait partie d'une famille de protéines dites structurales, le plus souvent présentes sous forme fibrillaire, protéines les plus abondantes des animaux, i.e. plus de 100 000 protéines différentes présentes dans la matrice extracellulaire (MEC).

Le collagène est étudié dans un chapitre spécifique et vous pouvez lire : Collagen glycosylation (2019).
1. Les chaînes de collagène sont modifiées, dans le réticulum endoplasmique (RE), par un disaccharide, i.e. glucoseα1-2galactoseβ1-0, qui est attaché sur le groupe hydroxyle de l'hydroxylysine (Hyl) par trois lysyl hydroxylases (PLOD).
-
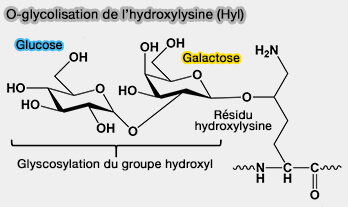
O-glycosylation de l’hydroxylysine (Hyl)
(Figure : vetopsy.fr) - L'enzyme qui ajoute du glucose au galactose sur les collagènes reste à identifier, peut-être la lysyl hydroxylase 3 humaine (LH3) pourrait-elle intervenir dans ce processus en plus de l'hydroxylation de la lysine.
2. L'O-glycosylation du collagène pourrait contrôler ou influencer le taux de formation de la triple hélice et, à son tour, la taille des fibrilles de collagène (Effect of hydroxylysine-O-glycosylation on the structure of type I collagen molecule: A computational study 2020).
- Une glycosylation excessive des hydroxylysines en fait de mauvais substrats pour la désamination enzymatique extracellulaire, la première étape de la réticulation du collagène.
- Certaines mutations du collagène de type IV perturbent l'intégrité vasculaire.
Glycanes O-fucose, O-glucose et O-GlcNAc des domaines EGF-like

Les glycosylations du domaine EGF-like sont étudiées dans un chapitre spécifique.
Remarque : une O-fucosylation survient aussi sur la sérine/thréonine entre la première et la deuxième cystéine des TSR (ThromboSpondin type-1 Repeat).



