Glucides
Glycosylation
: O-Glycosylation
Glycanes O-GalNAc (O-N-acétylgalactosamine)
- Biochimie
- Chimie organique
- Bioénergétique
- Composition de la matière vivante
- Transport membranaire
- Moteurs moléculaires
- Voies de signalisation

Les glycanes O-GalNAc (O-N-acétylgalactosamine) sont les glycanes les plus répandus et produisent des O-glycanes de type mucine qui sont généralement extracellulaires ou sécrétés.
Vue d'ensemble des glycanes O-GalNAc
(O-N-acétylgalactosamine)
1. De nombreuses glycoprotéines portent des glycanes initiés par la N-acétylgalactosamine (GalNAc) attachée au groupe hydroxyle ($\ce{-OH}$) des résidus de sérine ou de thréonine.

Les glycanes liés à la GalNAc sont abondants sur toutes les glycoprotéines extracellulaires et sécrétées et vous pouvez lire : O-GalNAc Glycans (2022).
(Figure : vetopsy.fr d'après Varki et coll)
Cette réaction s'effectue dans l'appareil de Golgi, après le repliement de la protéine, grâce à l'action :
- des nucléotides-oses pour ajouter GalNAc, mais aussi les autres glucides,
- des glycosyltransférases (EC 2.4.-.-), i.e. en particulier une vingtaine de GalNAc transférases ou GALNT.
2. La synthèse des glycanes O-GalNAc est initiée par les GalNAc transférases (GALNT) qui commencent par le transfert de GalNAc de UDP-GalNAc à Ser/Thr de la protéine qui peuvent former des coeurs différents, i.e. 1 à 4 (
a. Les GALNT diffèrent dans leur spécificité pour les motifs d’acides aminés, ce qui ajoute un niveau de régulation à la manière et à l’endroit où les O-glycanes sont attachés.
L’ajout séquentiel non modélisé de glycanes au GalNAc initial donne naissance à un ensemble diversifié de structures glucidiques qui sont souvent fortement regroupées sur certaines glycoprotéines, comme les mucines et l’immunoglobuline humaine A1 (IgA1).
b. Ces sucres sont ajoutés au fur et à mesure que la protéine se déplace dans les compartiments de l'appareil de Golgi, i.e. cis ➞ médian ➞ trans-Golgi et, contrairement aux N-glycanes, il n’y a pas de prétraitement et de post-traitement qui réduisent les structures de sucre existantes.
Au lieu de cela, les chaînes de glycopeptides O-glycanes sont modifiées par des glycosyltransférases distinctes qui peuvent étendre la structure existante avec d'autres glucides.
Remarque : l’antigène Tn, seul GalNAc non étendu lié à Ser/Thr, est rare dans les mucines normales, mais souvent trouvé à des niveaux accrus dans les mucines tumorales.
- Cela suggère que l’extension des glycanes O-GalNAc au-delà du premier sucre est bloquée dans certaines cellules cancéreuses.
- L'acide sialique ajouté à GalNAc par la ST6GALNAC1 α2-6 sialyltransférase génère l’antigène STn (sialyl-Tn), qui est fréquent dans les tumeurs avancées (Profiling of Naturally Occurring Antibodies to the Thomsen-Friedenreich Antigen in Health and Cancer: The Diversity and Clinical Potential 2020).
3. Les sucres trouvés dans les glycanes O-GalNAc, qui peuvent varier d'un seul GalNAc à plus de 20 résidus de sucre et peut inclure des épitopes de groupe sanguin et d'autres glycanes, comprennent aussi :
- du galactose (Gal), pouvant être modifié par sulfatation,
- de la N-acétyl-glucosamine (GlcNAc), pouvant être aussi modifié par sulfatation,
- du fucose (Fuc),
- des acides sialiques (Sia), pouvant être modifiés par O-acétylation.
Remarque : le mannose (Man), le glucose (Glc) ou le xylitol (Xyl) ne sont pas représentés.
Glycoprotéines impliquées
Mucines
Les mucines sont la classe de glycoprotéines portant le plus grand nombre de glycanes O-GalNAc.
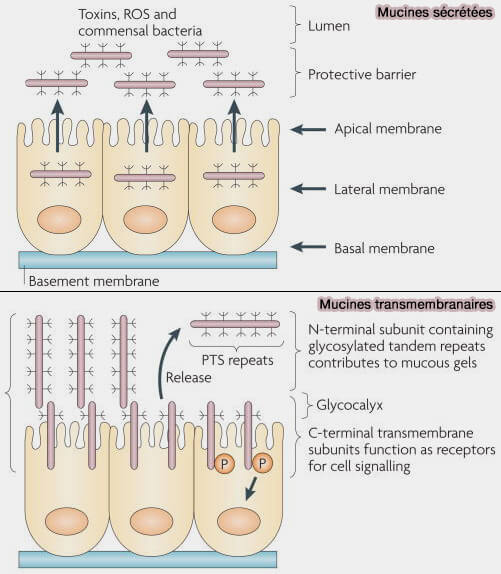
1. Les mucines forment une interface cruciale entre les cellules épithéliales et les surfaces muqueuses externes du corps.
Les mucines tapissent les voies gastro-intestinales et respiratoires pour protéger ces régions des infections (La structure des mucines conditionne les propriétés viscoélastiques des gels de mucus 2018).
- Les mucines sont chargées négativement, ce qui leur permet d'interagir avec l'eau et d'empêcher son évaporation.
- En cela, elles lubrifient les voies afin que les bactéries ne puissent pas se lier et provoquer d'infections.
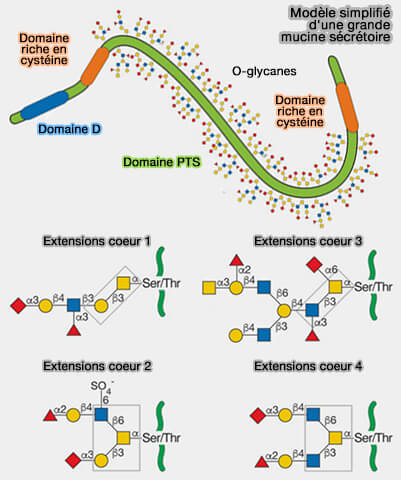
(Figure : vetopsy.fr d'après Kufe)
2. Les mucines sont caractérisées par un nombre variable de répétitions en tandem avec une teneur élevée en Pro, Ser et Thr, ce qui crée de nombreux sites pour l’O-glycosylation.
De plus, ces sites ont souvent des noyaux O-glycanes étendus qui créent une substance semblable à un gel censée protéger à la fois les glycoprotéines et les surfaces cellulaires :
- du stress externe,
- des infections microbiennes
- de l’auto-reconnaissance par le système immunitaire.
3. Leurs modifications provoquent un grand nombre de maladies, dont des cancers (Mucins in cancer: function, prognosis and therapy 2011 et Mucin in cancer: a stealth cloak for cancer cells 2021).
Groupes sanguins
Les sucres terminaux des O-glycanes sont reconnus par les lectines, dont le rôle est essentiel dans le système immunitaire et dans les groupes sanguins (ABO).
(Figure : vetopsy.fr)
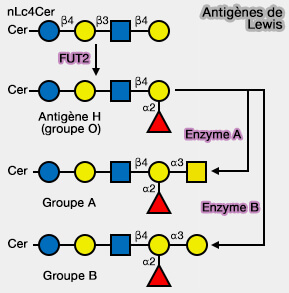
1. Le principal glycosphingolipide trouvé dans les érythrocytes humains est le globoside Gb4Cer (GalNAcβ1-3Galα1-4Galβ1-4Glcβ-Cer), qui, avec Gb3Cer, constitue la base du système des groupes sanguins.
L'addition du fucose, à parrtir de l'GDP-fucose par les fucosyltransférases (FUT), i.e. FUT2 (EC 2.4.1.65) forme des épitopes de Lewis et l'échafaudage des déterminants des groupes sanguins.
2. L'ajout d'un fucose seul crée l'antigène H, présent chez les personnes de groupe sanguin O.
- L'antigène A du groupe sanguin A est formé par l'ajout d'un GalNAc par l'α1-3N-acétyl-galactosaminyltransférase ou enzyme A.
- L'antigène B du groupe sanguin B est formé par l'ajout d'un galactose par l'α1-3 galactotransférase ou enzyme B.
3. Toutefois, de nombreux autres groupes sanguins ont été identifiés, outre les groupes ABO et rhésus (RH).
Le tableau suivant compare les caractéristiques cliniquement pertinentes des anticorps contre les principaux systèmes de groupes sanguins humains.
| ABO | Rh | Kell | Duffy | Enfant | |
|---|---|---|---|---|---|
| Réactions naturelles | Oui | Non | Non | Non | Non |
| Réactions transfusionnelles hémolytiques immédiates | A | Oui | Fya | Jka | |
| Réactions transfusionnelles retardées | E, D, C | Jka | |||
| Fréquent dans la maladie hémolytique du nouveau-né | Oui | D, C | Oui | ||
| Produit couramment une hémolyse intravasculaire | Oui | Oui |


