Glucides
Glycosylation
: O-Glycosylation
Glycanes O-GlcNAc (O-N-acétylglucosamine)
- Biochimie
- Chimie organique
- Bioénergétique
- Composition de la matière vivante
- Transport membranaire
- Moteurs moléculaires
- Voies de signalisation

Les glycanes O-GlcNAc (O-N-acétylglucosamine) sont les glycanes cytoplasmiques, nucléaires et mitochondriaux qui restent dans la cellule.
Vue d'ensemble des glycanes O-GlcNAc (O-N-acétylglucosamine)

Vous pouvez lire : Protein O-GlcNAcylation: emerging mechanisms and functions (2017) qui détaille précisément les mécanismes de cette O-glycosylation.
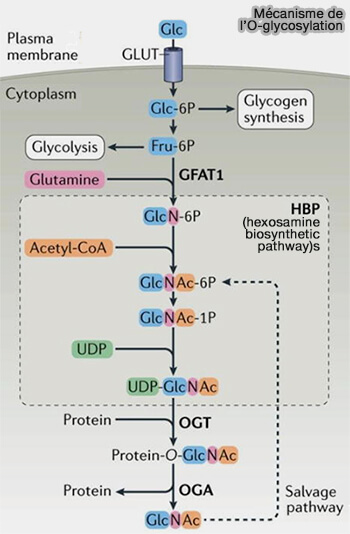
(Figure : vetopsy.fr d'après Yang et Qian)
1. L'ajout de N-acétylglucosamine (GlcNAc) aux résidus sérine ou thréonine se produit généralement sur les protéines cytoplasmiques, nucléaires et mitochondriales qui restent dans la cellule.
- Les modifications O-GalNAc se produisent généralement sur les protéines extracellulaires et sécrétées.
- Contrairement aux glycanes O-GalNAc, cette glycosylation n'est généralement pas présente dans l'appareil de Golgi et n'est pas étendue.
1. Deux enzymes s'engagent dans divers complexes protéiques d'une manière dépendante du contexte et spécifique au compartiment cellulaire et peuvent ainsi réguler de manière coordonnée des réseaux complexes de processus cellulaires spatialement séparés.
- l'OGT (O-GlcNAc transférase) qui ajoute un GalNAc, à prédominance nucléaire,
- l'OGA (O-GlcNAcase) qui enlève un GalNAc, à prédominance cytoplasmique.
a. Ces deux enzymes effectuent le même cycle rapide d'addition et de suppression de GlcNAc à partir de substrats protéiques.
Ce processus dynamique semble être unique à ce motif de glycosylation et est considéré comme régulant toutes les fonctions cellulaires, y compris le métabolisme cellulaire.
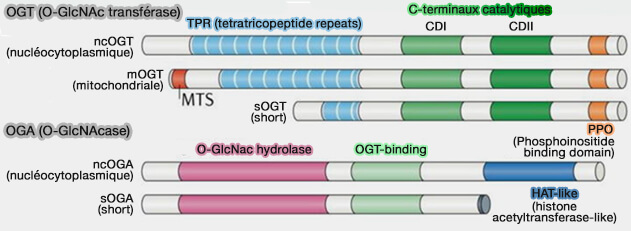
(Figure : vetopsy.fr d'après Yang et Qian)
b. En outre, la O-GlcNAcylation et la phosphorylation peuvent se produire sur les mêmes résidus de thréonine et de sérine, suggérant une relation complexe entre ces modifications qui peuvent affecter de nombreuses fonctions de la cellule (Cross Talk Between O-GlcNAcylation and Phosphorylation: Roles in Signaling, Transcription, and Chronic Disease 2011).
Elle est impliquée dans les cancers (The Nutrient-Sensing Hexosamine Biosynthetic Pathway as the Hub of Cancer Metabolic Rewiring 2018).
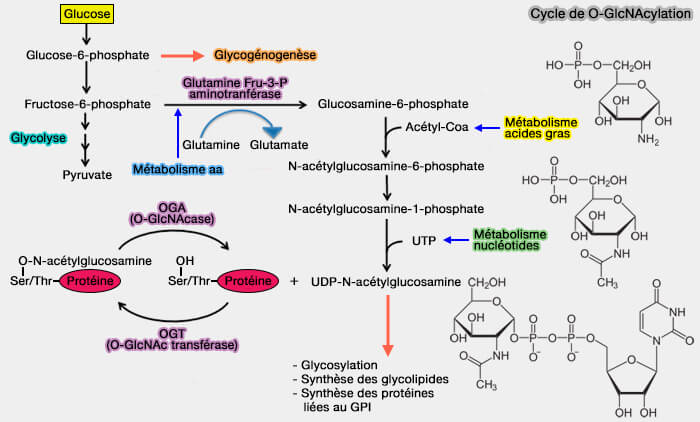
(Figure : vetopsy.fr)
Exemples
Cette modification post-traductionnelle régule les processus cellulaires fondamentaux.

Vous pouvez voir les fonctions spécifiques de la O-GlcNAcylation en fonction des tissus et du type cellulaire dans un tableau.
1. La régulation de la transcription par l'OGT (O-GlcNAc transférase) peut être constatée, entre autres, sur :
- les lymphocytes T et B, l'OGT O-GlcNAcylate les facteurs de transcription cruciaux comme le NFATc1 (Nuclear Factor of Activated T cells 1) et NF-κB (Nuclear Factor kappa B) et est nécessaire à l'activation des lymphocytes,
- les hépatocytes, la O-GlcNAcylation de CRTC2, FOXO1 et PGC-1α module l'expression des gènes gluconéogéniques…
2. L'OGT interagit avec divers régulateurs épigénétiques, comme les histones déacétylases ou HDAC) (EC 3.5.1.98) et diverses autres protéines impliquées dans la modification des histones et la méthylation de l'ADN.
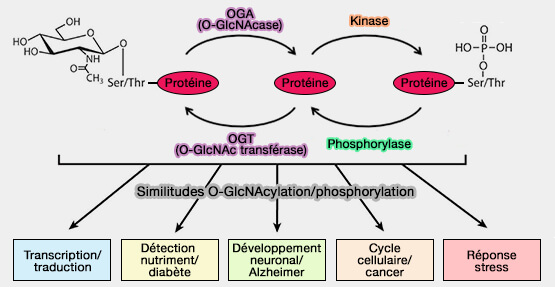
(Figure : vetopsy.fr)
3. L'OGT agit dans la dynamique de signalisation cellulaire en se liant par exemple avec PI(3)P, l'OGT intervient ainsi dans la régulation négative de la signalisation de l'insuline.
Au carrefour du métabolisme du glucose, des acides aminés, des acides gras et des nucléotides, la O-GlcNAcylation est particulièrement bien placée pour fonctionner comme un capteur de nutriments, couplant les fluctuations de leur disponibilité aux changements dans les voies de signalisation en aval.
Remarque : une voie non spécifique peut réguler la réponse UPR (Unfolded Protein Response) en augmentant l’expression du gène de la voie de biosynthèse de l’hexosamine (HBP) via le facteur de transcription X-box binding protein 1 (Xbp1s).
- L’augmentation de la production d’UDP-GlcNAc par le HBP peut conduire à une O-GlcNAcylation non spécifique des protéines dépliées dans le cytoplasme.
- L’O-GlcNAcylation des protéines dépliées peut bloquer leur agrégation et leur dégradation protéasomale ainsi que faciliter leur repliement par des chaperons ayant une activité lectine dirigée par O-GlcNAc, comme par exemple par Hsp70.
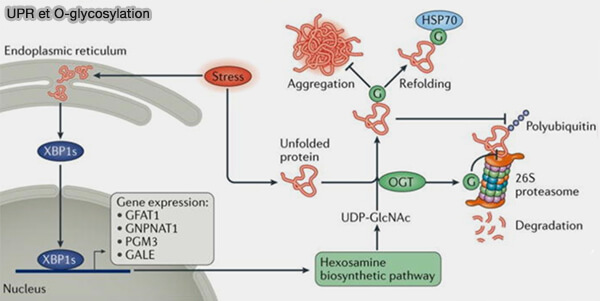
(Figure : vetopsy.fr d'après Yang et Qian)


