Glucides
Glycosylation : glycosyltransférases
- Biochimie
- Chimie organique
- Bioénergétique
- Composition de la matière vivante
- Transport membranaire
- Moteurs moléculaires
- Voies de signalisation

Les glycosyltransférases (GTF) sont des enzymes qui forment des liaisons glucosidiques à partir d'un donneur de glycosyle et d'un molécule nucléophile accepteur de glycosyle.
Vue d'ensemble
1. Pour transférer une unité glycosyle d'un donneur de glycosyle à un accepteur de glycosyle, il faut une réaction exergonique sous l'effet des glycosyltransférases (EC 2.4.).
a. Les donneurs de glucides sont :
- les nucléotides-oses en général,
- le dolichol phosphate (From glycosylation disorders to dolichol biosynthesis defects: a new class of metabolic diseases 2011).
b. Le groupement acide des accepteurs de glycosyle est l'hydrogène libre ($\ce{-H}$) d'une molécule autre que l'ose, i.e. ($\ce{R-OH}$) appelée aglycone, qui peut être :
- un alcool ($\ce{-OH}$), i.e. formation d'un O-glycoside ou O-glycane,
- une amine ($\ce{-NH2}$), i.e. formation d'un N-glycoside ou N-glycane,
- un thiol ($\ce{-SH}$), i.e. formation d'un S-glycoside ou S-glycane,
- un carbone d'une autre molécule plus rarement, i.e. formation d'un C-glycosyle ou C-glycane.
2. Il se forme une liaison glycosidique et le produit d'une telle réaction peut être :
a. un oligoside (oligosaccharide) ou un polyhoside ou polysaccharide (
b. un résidu protéique :
- l'asparagine dans les N-glycosylations, la plus répandue des glycosylations,
- la sérine ou la thréonine dans les O-glycosylations,
- le tryptophane dans les C-glycosylations.
c. un lipide pour former des glycolipides ou même un donneur de phosphate comme le dolichol phosphate (From glycosylation disorders to dolichol biosynthesis defects: a new class of metabolic diseases 2011).

Vous pouvez lire : Chapter 6 Glycosyltransferases and Glycan-Processing Enzymes (2022) de Essentials of Glycobiology [Internet]. 4th edition.
Localisation
La localisation des glycosyltransférases est :
- intra-golgienne, impliquée dans les glycosylations.
- nucléaire,
- cytoplasmique.
Voie intra-golgienne
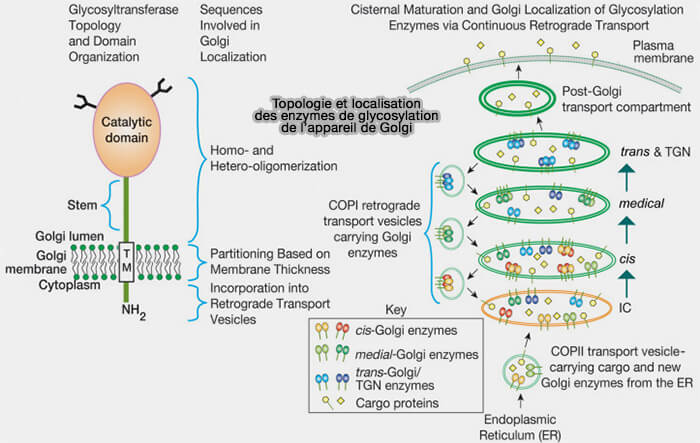
1. Les glycosyltransférases et les glycosidases de l'appareil de Golgi sont des protéines membranaires de type II dont les séquences catalytiques font face à la lumière du Golgi.
Les glycosidases qui éliminent les monosaccharides pour former des intermédiaires qui sont ensuite activés par les glycosyltransférases jouent également un rôle dans la biosynthèse de certains types de glycanes (
(Figure : vetopsy.fr d'après Colley et coll)
2. Selon le modèle de maturation cisternale du transport intra-Golgi, ces enzymes de glycosylation sont maintenues dans le Golgi et ségréguées dans différentes citernes via un transport rétrograde continu dans des vésicules recouvertes de COPI.
a. Leur incorporation dans ces vésicules est probablement médiée par l’interaction entre les séquences de leurs queues cytoplasmiques et les protéines associées aux vésicules enrobées.
- Par exemple, deux sous-unités de coatomères COPI sélectionnées se lient à un motif de séquence spécifique dans les queues cytoplasmiques N-terminales d’un certain nombre d’enzymes de glycosylation de Golgi.
- Des mutations de ce motif dans l’enzyme GlcNAc-1-phosphotransférase modifient les enzymes lysosomales et conduisent à sa mauvaise localisation, provoquant la mucolipidose III, une maladie de surcharge lysosomale.
b. La répartition sélective des enzymes de glycosylation dans les membranes joue également un rôle dans leur localisation de Golgi.
- Les différences de longueur transmembranaire (TM) et d’hydrophobie permettent la répartition sélective de ces enzymes dans différents compartiments à faible teneur en cholestérol, i.e. membranes plus minces, ou à forte teneur en cholestérol, i.e. membranes plus larges.
- En général, les régions TM relativement courtes de ces enzymes peuvent empêcher leur répartition dans les compartiments de transport post-Golgi qui partagent la membrane plus large et riche en cholestérol trouvée à la surface cellulaire.
3. La dimérisation et l’hétéro-oligomérisation des enzymes de glycosylation de Golgi, médiées par leurs séquences luminales, peuvent également être importantes pour la localisation des enzymes et la glycosylation efficace dans certaines voies.
Remarque : en biologie, mais pas toujours en chimie, la glycosylation fait généralement référence à une réaction catalysée par une enzyme.
La glycation, i.e. glycation ou glycosylation non enzymatique, fait référence à une réaction spontanée qui se produit principalement dans la circulation sanguine pour une faible proportion des sucres simples.
Voies nucléaire et cytoplasmique
1. Dans les voies nucléaire et cytosolique, les considérations topologiques sont inversées, car les sites actifs des glycosyltransférases concernées pour ces réactions sont confrontés au cytoplasme.
Les types de glycanes trouvés sur les deux côtés de la membrane cellulaire jusqu'à présent semblent être distincts l'un de l'autre.
2. Certaines protéines destinées à l'espace extracellulaire n'entrent jamais dans la lumière du RE, mais sont transférées directement à travers la membrane plasmique, par des mécanismes encore mal définis,
C'est le cas, par exemple, des cytokines IL-1 et IL-18, du facteur de croissance 2 (FGF2) ou des galectines.
La plupart de ces protéines ont des propriétés de liaison aux glycanes, ce qui causerait probablement des problèmes si elles traversaient la voie RE-Golgi riche en glycanes.
Mécanisme des glycosyltransférases
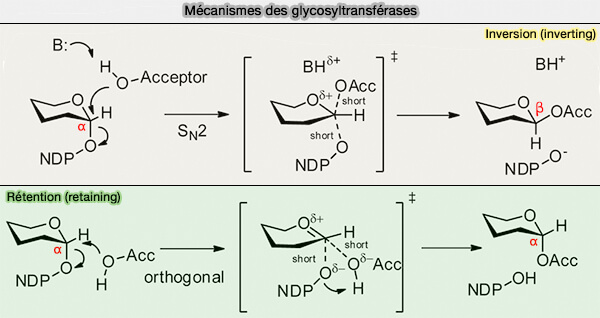
Les glycosyltransférases, par analogie avec les glycosylhydrolases, catalysent le transfert de l'ose selon un mécanisme (Structural basis of the molecular ruler mechanism of a bacterial glycosyltransferase 2018) :
- de rétention, i.e. retaining en anglais, le carbone anomérique est conservé, α → α,
- d'inversion, i.e. inverting en anglais, qui inverse la configuration du carbone glycosidique, α → β.
(Figure : vetopsy.fr d'après Brock.Schuman)
La plupart des glycosyltransférases sont métallo-dépendantes, envers le magnésium ou le manganèse, qui jouent le rôle d'acides de Lewis en acceptant les électrons du groupe activateur.


