Protéines
Superfamille des globines
Hémoglobine : affinité pour le monoxyde d'azote (NO) et le monoxyde de carbone (CO)
- Biochimie
- Transport membranaire
- Moteurs moléculaires
- Voies de signalisation

Outre pour l'oxygène (O2) et le gaz carbonique (CO2), l'hémoglobine a aussi une affinité pour le monoxyde d'azote (NO) et le monoxyde de carbone (CO).
Affinité pour le monoxyde d'azote (NO)
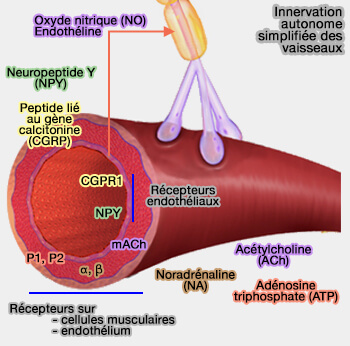
NO, le monoxyde d'azote, est un gaz incolore, réactif et instable dans l’air, mais qui est produit principalement par les cellules endothéliales par la NO synthase (ou NOS) et qui joue un rôle de vasodilatateur.
(Figure : vetopsy.fr)
Il intervient aussi dans la communication neuronale, l'immunité, i.e. macrophages produisent aussi du NO pour la destruction des agents pathogènes…
Fixation sur l'hème : HbNO
NO peut se fixer sur l'hème de l'hémoglobine (Hb) comme O2 et former de la nitrosylhémoglobine (HbNO).
$\ce{Hb- + NO}$ $\longrightarrow$ $\ce{HbNO}$
1. HbNO a plusieurs fonctions :
- transport du NO dans le sang de façon temporaire, pour le protéger contre une dégradation rapide et limiter sa diffusion,
- réservoir ou tampon de NO, car NO est une molécule très réactive et instable.
2. Son rôle est de piéger le NO, mais, dans certaines conditions très précises, HbNO peut libérer du NO, bien moins fréquemment et facilement que SNO-Hb.
a. HbNO peut subir une oxydation par l'oxygène directement ou par l’oxyhémoglobine (HbO2), passage du Fe++ au Fe+++, pour former la méthémoglobine (MetHb) qui ne peut plus tranporter l'O2.
$\ce{HbO2 + NO}$ $\longrightarrow$ $\ce{MetHb + NO3-}$
b. Ces dérivés réactifs de l’azote (RNS) peuvent ensuite nitrosyler des thiols pour former SNO-Hb…
Fixation sur Cysβ93 : SNO-Hb
NO peut aussi se fixer sur la cystéine 93 des chaînes β, i.e. groupe thiol ou sulfhydryle ($\ce{−SH}$), pour former une S-nitroso-hémoglobine (SNO-Hb), résultat d'une S-nitrosylation.
$\ce{Hb-Cys-SH + NO}$ $\longrightarrow$ $\ce{Hb-Cys-S-NO ou SNO-Hb}$
1. La libération de NO provoque une vasodilatation, améliorant la circulation du sang et l’apport en oxygène quand la pression partielle en O2 (PO2) est basse, comme dans les tissus en manque d’oxygène, i.e. hypoxie, activité physique (
- Par rapport à HbNO, SNO-Hb peut être considéré comme un réservoir mobile de NO bioactif.
- Elle permet de libérer NO de façon régulée en fonction des conditions locales, i.e. pH, PO2…
| Aspect | HbNO | SNO-Hb |
|---|---|---|
| Lieu de fixation | Fer (Fe++) du groupe hème | Thiol (-SH) sur cystéine (Cysβ93) |
| Type de liaison | Coordination (liaison métal-gaz) | Liaison covalente S-nitrosylée |
| Stabilité | Très stable | Modéremment stable |
| Rôle principal | Transport et stabilisation du NO (piègeage passif) |
Transport et libération régulée de NO |
| Libération de NO | Moins facile, plus stable | Plus facile, plus dynamique |
| Fonction physiologique | Réservoir temporaire en éliminant NO de la circulation |
Régulation fine de la vasodilatation locale |
2. En outre, SNO-Hb participe au couplage entre la libération d’O2 et la libération de NO, optimisant l’apport en oxygène selon les besoins.
- SNO-Hb se forme lorsque l’Hb est oxygénée, i.e. le passage de la forme T à la forme R dans les poumons favorise la nitrosylation du thiol de Cysβ93-Cys par le NO.
- Dans les tissus, la désoxygénation de l’Hb inverse la conformation, i.e. forme R à T, ce qui provoque une réduction de l’affinité de l’Hb pour le NO et donc, sa libération au bon endroit.

Une molécule d’hémoglobine peut donc fixer de l’O2 sur ses hèmes et simultanément stocker du NO sur Cysβ93, ce qui rend l’hémoglobine si efficace pour ajuster l’apport en O2 aux besoins tissulaires.
Affinité pour le monoxyde de carbone (CO)
Le monoxyde de carbone (CO) peut se lier à l'ion Fe++ de l'hème de l'hémoglobine, pour former la carboxyhémoglobine (HbCO).
1. La carboxyhémoglobine (HbCO), très stable, donc difficile à éliminer rapidement, est incapable de transporter l’oxygène, ce qui provoque une hypoxie tissulaire.
a. Son affinité est 200 à 250 fois plus élevée que celle de l'O2, et sa toxicité est forte par inhalation, i.e. fumée, gaz d’échappement, chauffage défectueux…
- Le CO possède un doublet non liant sur le carbone qu’il donne au Fe++, i.e. liaison σ et il reçoit des électrons d des orbitales du fer.
- La conséquence est que son champ de ligand est beaucoup plus fort que celui de l'O2.
- Fe++ passe en état bas spin durablement et stabilise plus fortement la forme R, qui est celle de l'oxyhémoglobine.
b. L’hémoglobine " croit être saturée ".
- CO se fixe sur l'un des hèmes et le passage à la forme R permet aux autres sites de fixer très bien l’O2.
- Cependant, ils ne le relâchent plus facilement dans les tissus et on assiste à une hypoxie même si le sang semble bien oxygéné (rouge vif), les tissus manquent d’oxygène.
(Figure : vetopsy.fr)
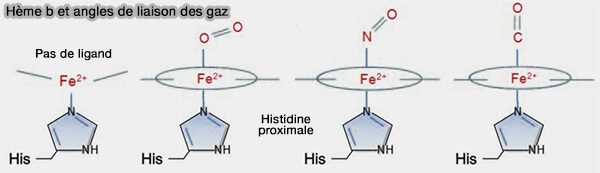
2. L'histidine distale (E7), par son encombrement stérique, protège l'hème de cette liaison (Binding and Docking Interactions of NO, CO and O2 in Heme Proteins as Probed by Density Functional Theory 2009).
La liaison préférée de CO est linéaire, contrairement à celle de l’oxygène avec un coude de 120°.
Récapitulatif des gaz transportés par l'hémoglobine
| Gaz | Forme transportée par l'Hb | Site de liaison | Effet principal |
|---|---|---|---|
| Oxygène (O2) | Oxyhémoglobine (HbO2) | Fer (Fe++) de l'hème | Transport d'O2 des poumons aux tissus |
| Dioxyde de carbone (CO2) | Carbaminohémoglobine (HbCO2) | Groupes amines des globines | Transport de CO2 des tissus aux poumons |
| Monoxyde de carbone (CO) | Carboxyhémoglobine (HbCO) | Fer (Fe++) de l'hème | Empêche le transport de l'O2 (toxique) |
| Monoxyde d'azote (NO) | Hb–NO ou SNO-Hb |
|
Régulation du tonus vasculaire |


