Neurophysiologie phéromonale
Organe voméronasal
Récepteurs : V2R et récepteurs olfactifs
- Sens chimiques
- Olfaction
- Vue d'ensemble du système olfactif accessoire (VNS) et des phéromones
- Généralités sur les phéromones
- Perception des phéromones
- Neurophysiologie phéromonale
- Sécrétions
et excrétions contenant des phéromones
- Régions
cutanées sécrétrices des phéromones
- Glandes anales
- Glandes jugales
- Glandes podales
- Sécrétions maternelles
- Sécrétions ou excrétions non cutanées
contenant des phéromones
- Phéromones urinaires
- Autres excrétions
- Régions
cutanées sécrétrices des phéromones
- Phéromones et communication
- Phéromonothérapie
- Gustation
- Vision
- Système somatosensoriel

Les V2R, récepteurs de l'organe voméronasal, sont localisés dans sa région basale et sont absents dans un grand nombre d'espèces dont le chien et le chat.
| Récepteurs olfactifs (sens large) |
Homme | Souris | Rat | Chien | Vache | Poulet | Grenouille | Poisson zèbre |
|---|---|---|---|---|---|---|---|---|
| Récepteurs phéromonaux | ||||||||
| V1R | 5 (115) |
187 (121) |
106 (66) |
8 (33) |
40 (45) |
0 (0) |
21 (2) |
2 (0) |
| V2R | 0 (7) |
70 (139) |
59 (109) |
0 (5) |
0 (8) |
0 (0) |
249 (448 |
44 (8) |
| Récepteurs olfactifs | ||||||||
| OR | 388 (414) |
1037 (354) |
1201 (292) |
876 (326) |
970 (1159) |
82 (476) |
410 (418) |
102 (35) |
| TAAR | 6 (3) |
15 (1) |
17 (2) |
2 (2) |
17 (9) |
3 (0) |
2 (1) |
109 (110) |
Remarque : le tableau ci-dessus qui date de 2009 permet d'avoir une idée approximative du nombre de gènes intacts, ainsi qu'entre parenthèses, le nombre de pseudogènes, i.e. gènes inactifs au sein d'un génome, du fait d'altérations génétiques les rendant non fonctionnels, et donc incapables de conduire à l'expression d'une protéine (From Pheromones to Behavior 2009).

Le nombre de récepteurs olfactifs a bien augmenté depuis.
Neurones voméronasaux basaux: récepteurs V2R
Sous-familles de V2R
Les V2R ont été particulièrement bien étudiés chez la souris, appelés Vmn2r, et sont représentés par 4 sous-familles, A à D, qui comptent environ 279 membres à l'heure actuelle, dont 159 pseudogènes (V2R gene families degenerated in primates, dog and cow, but expanded in opossum 2007).
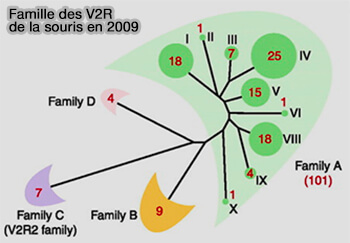
(Figure : vetopsy.fr d'après Tirindelli et coll)
1. La plupart des gènes, 85 %, plus de 100, appartiennent à la sous-famille A, qui est elle-même subdivisée en neuf clades.
La famille D ne contient que 4 gènes.
2. La sous-famille C (V2r2) est particulière car chaque neurone voméronasal (VSN) basal ne suit pas la règle, un neurone, un récepteur car il exprime :
- un membre de la sous-famille C, i.e. sept gènes hautement homologues (identité de séquence à 80 %) chez la souris,
- un membre de la sous-famille A, B ou D (Coordinated coexpression of two vomeronasal receptor V2R genes per neuron in the mouse 2011).
La coexpression des gènes Vmn2r de la famille C permet une expression variée des modèles d'expression des V2R, comme peut-être la protéine atypique Orco qui fonctionne comme corécepteur obligatoire dans les neurones olfactifs des insectes (An Engineered orco Mutation Produces Aberrant Social Behavior and Defective Neural Development in Ants 2017).
3. Chez la souris, la couche basale des VSN peut être subdivisée en deux sous-couches selon l'absence ou la présence des gènes du complexe majeur d'histocompatibilité (CMH) de classe 1b (Signaling mechanisms and behavioral function of the mouse basal vomeronasal neuroepithelium 2014).
- La couche intermédiaire de VSN est négative pour le CMH de classe Ib.
- La couche la plus basale est positive pour le CMH de classe Ib (Expression of Nonclassical Class I Major Histocompatibility Genes Defines a Tripartite Organization of the Mouse Vomeronasal System 2008).
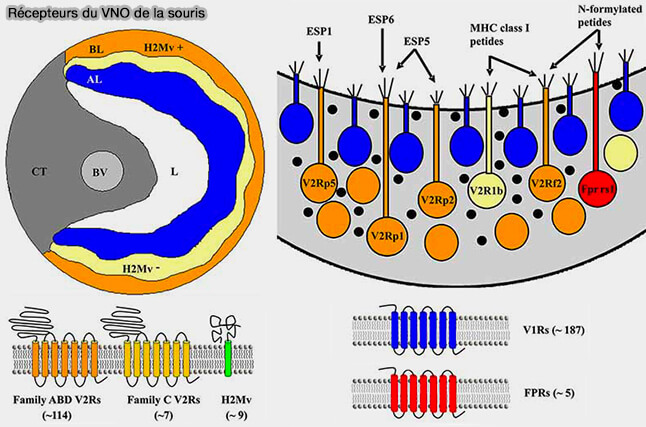
(Figure : vetopsy.fr d'après Pérez-Goméz et coll)
a. Ces protéines se localisent aux extrémités dendritiques des VSN, tout comme TRPC2 et Gαo.
- Chacun des neuf gènes de cette famille CMH (M1, M9, M11 et six membres de la famille M10) est exprimé dans un sous-ensemble de neurones positifs pour Gαo.
- La plupart des neurones expriment un seul gène, certains peuvent en exprimer deux ou trois.
b. Avec le B2M (β2-microglobuline), essentielle à la bonne expression des molécules du CMH de classe Ib à la surface cellulaire, les CMH forment un complexe protéique nécessaire au transport du récepteur vers la membrane plasmique.
 .
.
La coexpression non aléatoire d'un gène V2R de la famille A/B/D avec un seul gène de la famille C et soit aucun, soit l'un des neuf gènes H2-Mv est susceptible de conférer un phénotype fonctionnel unique à tout VSN basal donné (From genes to social communication: molecular sensing by the vomeronasal organ 2012)
Variations
La sous-famille C présente une ou très peu de mutations inactivantes, également dans les pseudogènes humains, ce qui suggère une perte de fonction relativement récente.
Si chez les rongeurs, ces récepteurs sont largement répandus, ils semblent complètement dégénérés chez les primates, les chiens et les vaches.
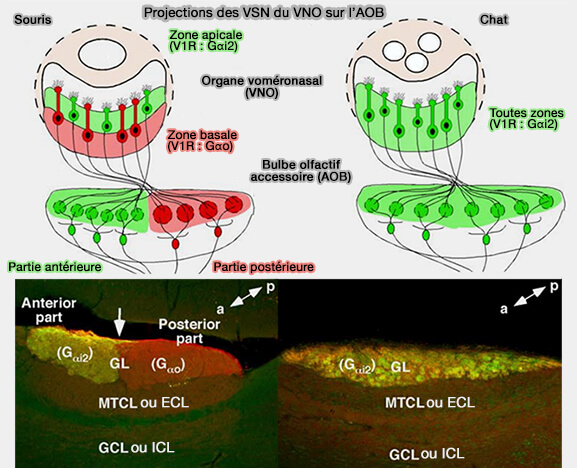
(Figure : vetopsy.fr d'après Yokosuka)
Chez le chien, l'absence d'une V1R importante et de la famille V2R ne reflète probablement pas une réduction de la pertinence de la communication phéromonale dans le déclenchement de comportement intraspécifique, mais plutôt une baisse générale du système voméronasal, une hypothèse qui est soutenue par des données anatomiques (
Mécanisme et rôles
Les V2R, liés à la protéine Gαo, sont situés dans la plupart des cellules du compartiment basal du VNO.
Comme les récepteurs métabotropes glutamatergiques (mGluR) les récepteurs sensibles au Ca++ (CaSR)et les récepteurs du goût T1R, les V2R récepteurs couplés aux protéines G (GPCR) de classe C de type glutamate.
1. Leur longue extrémité N-terminale hydrophobe, fréquemment appelée domaine Venus flytrap, i.e. Dionée attrape mouche, plante carnivore, sert de domaine de liaison pour les phéromones (Olfactory receptors: GPCRs and beyond 2009).
Compte tenu de leur grand site de liaison au ligand extracellulaire putatif, les V2R devraient détecter préférentiellement les gros peptides et protéines non volatils.
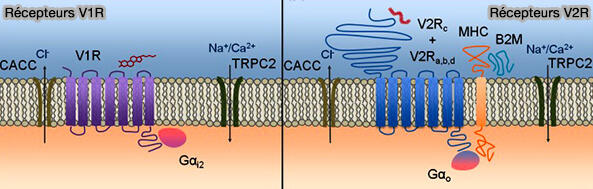
(Figure : vetopsy.fr d'après Ibarra-Soria et coll)
2. Les V2R et et les protéines Gαo réagissent aux peptides et aux protéines hydrosolubles, en particulier aux MUP (Major urinary proteins), que l'on peut trouver dans l'urine et d'autres sécrétions corporelles des souris et d'autres espèces.
a. Ces signaux peptidiques induisent l'effet Bruce chez les souris femelles, qui inhibent l'implantation de l'oeuf et relance l'oestrus de la femelle fécondée lorsqu'ils sont ajoutés à l'urine masculine (Pheromones and signature mixtures: defining species-wide signals and variable cues for identity in both invertebrates and vertebrates 2010).
b. D'autres ligands protéiques comme les produits des familles MUP (Major urinary proteins) et Esp (Exocrine-secreted peptides) codent pour l'identité et initient de diverses manières des comportements:
- de reconnaissance (Pheromonal Induction of Spatial Learning in Mice 2012),
- sexuels ou attractifs (The male mouse pheromone ESP1 enhances female sexual receptive behaviour through a specific vomeronasal receptor 2010),
- agressifs (Identification of protein pheromones that promote aggressive behaviour 2007) ou défensifs (The Vomeronasal Organ Mediates Interspecies Defensive Behaviors through Detection of Protein Pheromone Homologs 2010).
Récepteurs olfactifs
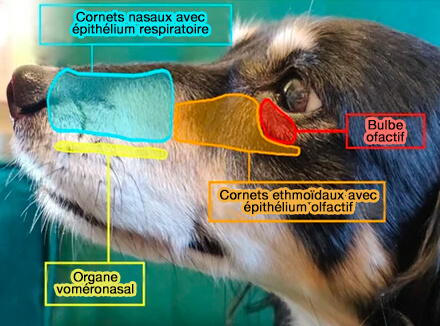
(Photo : vetopsy.fr d'après Buzek et coll)
Récepteurs OR
Chez la souris, une cinquantaine de gènes de récepteurs olfactifs (OR) sont exprimés dans l'épithélium voméronasal avec Gαi2 and TRPC2 (Cells in the vomeronasal organ express odorant receptors but project to the accessory olfactory bulb 2006),
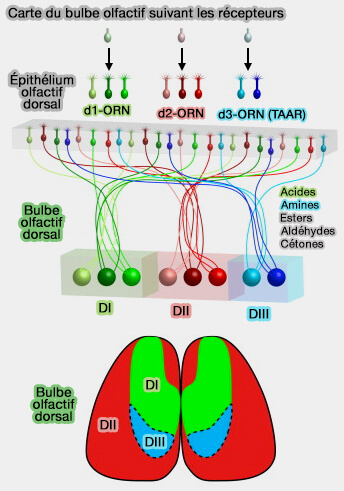
(Figure : vetopsy.fr d'après Pacifico et coll)
Certaines odeurs sont détectées par l'épithélium voméronasal et les expérimentations actuelles ont montré que les stimuli volatils et phéromonaux détectés respectivement par le bulbe olfactif principal (MOB) et le bulbe olfactif accessoire (AOB) provoquent des réponses qui se chevauchent de manière fonctionnelle et comportementale dans ces systèmes (Electrophysiological Evidence for a Direct Link between the Main and Accessory Olfactory Bulbs in the Adult Rat 2016 et Innate versus learned odour processing in the mouse olfactory bulb 2009).
Récepteurs TAAR
Les TAAR (Trace amine-associated receptor), récepteurs associés à une amine trace, sont retrouvées dans l'urine humaine et de rongeurs.
La stimulation de TAAR de l'épithélium olfactif (MOE) des souris semble donc intervenir dans la reconnaissance des sexes et le statut social d'un individu.
Or, comme le nombre de neurones exprimant TAAR et VR2 est plus élevé pendant les périodes de développement comportemental qu'à l'âge adulte, on pense qu'ils pourraient être essentiels pour les interactions petits-mère (Expression of Trace Amine–Associated Receptors in the Grueneberg Ganglion 2007).
Remarque : les récepteurs des glomérules à " collier ", i.e. récepteurs GC-D et MS4A, pourraient aussi intervenir dans la communication sémiobiotique
Transduction voméronasale
Sens chimiquesOlfactionCommunication olfactiveVue d'ensemble du système olfactif accessoire (VNS) et des phéromonesPerception phéromonaleOrgane voméronasal (VNO)Transduction voméronasaleBulbe olfactif accessoire (AOB)Voies ascendantesSécrétions et excrétions phéromonalesCommunication phéromonalePhéromones et marquagesPhéromones et organisation socialePhéromones et reproductionPhéromones et alarmePhéromonothérapie


