Bases moléculaires de la mémoire à long terme
Potentialisation à long terme (1)
- Généralités sur la mémoire
- Bref historique de la mémoire
- Modèles et définitions de la mémoire
- Différentes mémoires
- Bases
neurobiologiques de la mémoire
- Bases neurobiologiques générales de la mémoire
- Bases neurobiologiques de la mémoire à court terme
- Bases neurobiologiques de la mémoire de travail
- Bases neurobiologiques de la mémoire à long
terme
- Bases anatomiques de la mémoire à long terme non-déclarative
- Bases anatomiques de la mémoire
à long terme déclarative
- Bases anatomiques de la mémoire à long terme déclarative : découvertes
- Bases anatomiques de la mémoire à long terme déclarative : lobes temporaux
- Bases anatomiques de la mémoire à long terme déclarative : diencéphale
- Bases anatomiques de la mémoire à long terme déclarative : lobes frontaux
- Bases anatomiques de la mémoire émotionnelle : système limbique
- Bases moléculaires de la mémoire à long terme
La mémoire à long terme en général a été étudiée du point de vue :
- de la psychologie
cognitive (
processus de la mémoire à long terme),
- des régions cérébrales mises en jeu (
bases neurobiologiques).
Intéressons-nous maintenant à la neurobiologie cellulaire et en particulier à la potentialisation à long terme ( PLT).
Découverte de la potentialisation à long terme ou PLT
La potentialisation à long terme a été mise
en évidence dans l'hippocampe (
L'hippocampe, impliqué dans la mémoire à long terme (souvenir et rappel), a une structure simple pour du cortex (3 couches au lieu des 6 habituelles).
- De plus, il reste vivant plusieurs heures après son ablation.
- Il peut, en outre, être coupé en tranches minces pour pouvoir stimuler les différentes cellules, ce qui a facilité l'étude de la PLT.

Lorsque les axones de l'hippocampe sont stimulés à haute fréquence, on observe une augmentation de la transmission synaptique pendant un longue période (plusieurs heures et, même si elle est répétée, jusqu'à plusieurs semaines et peut-être, toute la vie).
- Lors d'une seule stimulation du neurone présynaptique, on enregistre un potentiel postsynaptique excitateur (PPSE).
- Après une stimulation à haute fréquence (centaines d'impulsions par seconde), on applique une seule stimulation : le PPSE est augmenté en amplitude et dure beaucoup plus longtemps.
PLT : dépolarisation durable et augmentée
Vue d'ensemble
Dans l'hippocampe , la stimulation des collatérales de Schaffer entraîne une dépolarisation des cellules pyramidales du CA1.
Une tétanisation même très brève peut provoquer une potentialisation à long terme. Le tissu hippocampique est très facilement excitable, ce qui explique le nombre de foyers épileptogènes dans cette région.
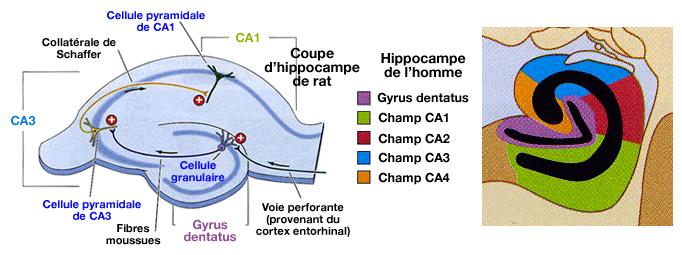
(Figure : vetopsy.fr d'après Bear-Connors-Paradiso)

Ces phénomènes font intervenir les différents récepteurs au glutamate.
1. Au niveau présynaptique, la fréquence
des stimulations doit être élevée et le nombre de synapses
suffisant pour provoquer une sommation des potentiels postsynaptiques excitateurs (PPSE), i.e. augmenter la libération du glutamate dans
la fente synaptique (
2. Au niveau postsynaptique, les décharges à haute fréquence du neurone présynaptique peuvent déclencher deux sortes de phénomènes.
- Si le potentiel membranaire postsynaptique est normal (- 70 mV), le
glutamate ne provoquera que l'ouverture des récepteurs ionotropes
AMPA (
bases neurobiologiques de la sensibilisation).
- Si le potentiel membranaire postsynaptique est bas (- 30 mV), le glutamate provoquent non seulement l'ouverture de nombreux récepteurs ionotropes AMPA de glutamate, mais également, l'expulsion des ions Mg++ des récepteurs NMDA, ce qui permet une entrée massive du Ca++ dans la cellule postsynaptique.
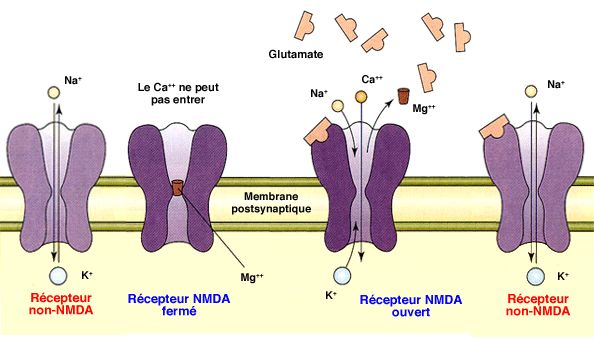
(Figure : vetopsy.fr d'après Squire-Kandel : La mémoire)
Le récepteur NMDA ne s'ouvre que lorsque les deux conditions suivantes
sont réunies : liaison du glutamate ET forte dépolarisation du neurone postsynaptique (
On les appelle récepteurs à double portillon ou double mécanisme d'activation, i.e. les deux phénomènes doivent arriver pratiquement en même temps (100 ms).

Ce double mécanisme d'action nous permet de penser que le récepteur
NMDA peut être impliqué dans les apprentissages associatifs
qu'il soit classique ou opérant (
Rôle des ions calcium (Ca++)
Revenons
à l'entrée massive du Ca++ : il active la calmoduline (
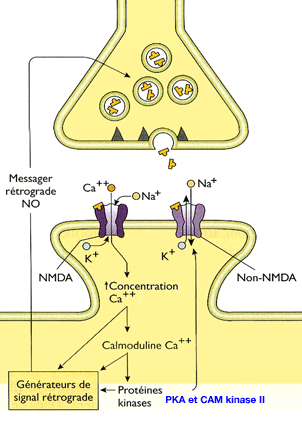
Squire-Kandel : La mémoire)
1. D'une part, en se fixant sur l'adénylate cyclase, la Ca++-calmoduline
produit une grande quantité d'AMPc qui augmente l'activité
de la protéine kinase A ou PKA (
La PKA phosphoryle les canaux K+ et les ferme, augmentant ainsi la durée du potentiel d'action neuronal.
- Ce phénomène ouvre alors davantage de canaux calcium dont la concentration augmente dans le neurone présynaptique, ce qui, à son tour, ouvre encore plus de récepteurs ionotropes AMPA.
- Ce phénomène, à son tour, agit par feed-back sur le neurone présynaptique pour lui ordonner de libérer plus de glutamate, par la sécrétion de messagers (comme le monoxyde d'azote NO).
2. D'autre part, la Ca++-calmoduline active, d'autre part, la protéine kinase II calmoduline-dépendante (CaM kinase II) dont le rôle, comme toutes les kinases, est la phosphorylation d'autres molécules.
- D'abord, elle s'auto-phosphoryle, ce qui permettra son activation, même lorsque les canaux Ca++ seront fermés.
- Puis, elle phosphoryle les récepteurs NMDA pour les rendre plus sensibles à l'entrée du Ca++.

Tous ces phénomènes concourent à l'augmentation de la force et de la durée du potentiel d'action !
3. De plus, l'action des kinases induit la production de protéines nécessaire aux changements durables de la connexion synaptique par la synthèse de récepteurs et de dendrites.
La facilitation à long terme de l'aplysie en est un exemple caractéristique.


