Fusion membranaire : mécanisme
Formation du pore de fusion (2)
Rôles des lipides et des SNARE
- Biologie cellulaire et moléculaire
- Constituants de la cellule
- Transport membranaire
- Transports membranaires sans mouvements membranaires
- Transports membranaires avec mouvements membranaires : trafic vésiculaire
- Protéines membranaires
- Moteurs moléculaires
- Voies de signalisation

Le mécanisme de la formation du pore de fusion est dépendant :
Lipides, courbure membranaire et formation du pore
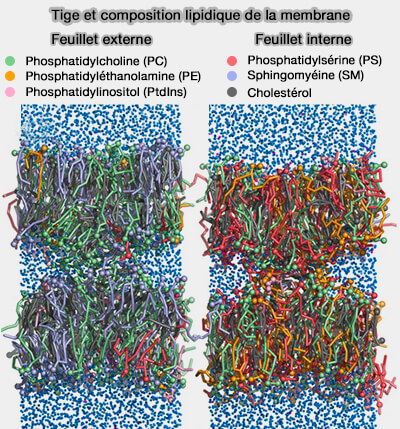
1. Le feuillet interne d'une membrane plasmique typique de mammifère est plus fusogène que le feuillet externe d'environ 50kJ/mol.
Un feuillet interne fusogène facilite l'exocytose, augmentant ainsi les taux de fusion et réduisant la consommation d'énergie requise par les protéines de fusion.
(Figure : vetopsy.fr d'après Lorent et coll)
Cette fusogénéicité est due au nombre de queues polyinsaturées des lipides (
- Les acides gras insaturés rendent les lipides plus coniques, car les doubles liaisons augmentent le désordre de la queue et, par conséquent, le volume effectif des queues lipidiques.
- En plus de ces effets par la forme géométrique des lipides, l'abondance accrue de doubles liaisons augmente la flexibilité conformationnelle des lipides, permettant ainsi à la membrane de s'adapter plus facilement à la courbure, ce qui peut favoriser davantage la fusion (From zero to six double bonds: phospholipid unsaturation and organelle function 2015).
Un feuillet externe moins fusogène pourrait empêcher l'infection par des virus enveloppés qui fusionnent avec la membrane plasmique par sa forte teneur en sphingomyéline (SM), du nombre réduit de queues polyinsaturées et de la teneur accrue en phosphatidylcholine (PC) par rapport à la phosphatidyléthanolamine (PE).
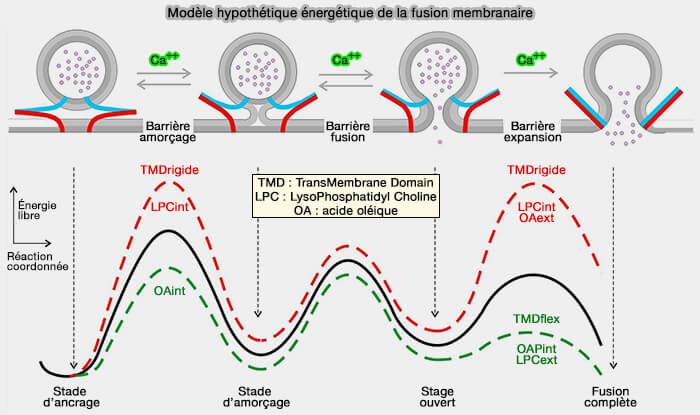
2. L'ouverture et l'expansion du pore de fusion, comme l'élargissement de la tige, impliquent des membranes hautement incurvées et sont donc contrôlées par la courbure des lipides (Synergistic actions of v-SNARE transmembrane domains and membrane-curvature modifying lipids in neurotransmitter release 2020).
(Figure : vetopsy.fr d'après Dhara et coll)
La figure ci-dessus représente l'évolution des vésicules du stade d'ancrage à la fusion complète.
- La fermeture à glissière progressive des SNARE, i. e. synaptobrévine 2/VAMP2, syntaxine et SNAP-25 non représenté, avec Ca++ entraîne les réactions directes tout au long du processus de fusion en surmontant les barrières énergétiques pour l'amorçage et la fusion jusqu'à l'expansion du pore de fusion.
- La rigidité des domaines transmembranaires (TMD) augmente l'énergie d'amorçage et l'expansion des pores, tandis que la flexibilité des TMD diminue cette dernière.
- L'OA (acide oléique) intracellulaire sauve en partie le déficit de sécrétion du mutant VAMP2polyL, i.e. qui contient des résidus leucine stabilisant le TMD, car la courbure spontanée du feuillet cytoplasmique est énergétiquement significative dans la formation de la tige.
Pour l'expansion des pores, l'OA et le LPC (lysophosphatidylcholine) produisent des effets opposés dans le même feuillet, mais des actions similaires lorsqu'ils sont appliqués aux différents feuillets, ce qui est cohérent avec les changements induits par la courbure de la membrane dans la cinétique d'expansion d'un pore purement lipidique.
Rôle des SNARE dans la formation du pore
Vue d'ensemble
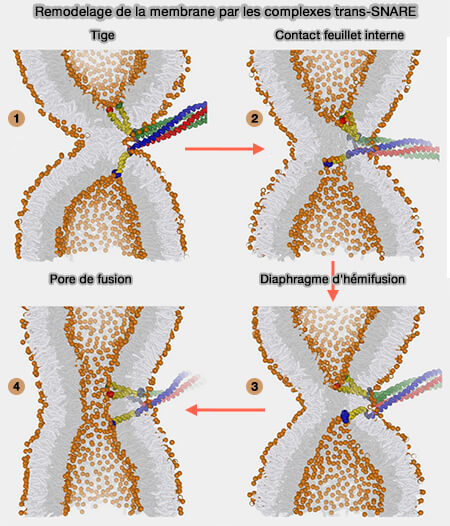
1. Le travail est fourni par la fermeture à glissière des SNARE, i.e. passage d'une conformation dépliée à une conformation continue α-hélicoïdale et pliage en même temps, qui produit une force agissant sur les extrémités C-terminales de leurs domaines transmembranaires ou TMD (
Cette force indente progressivement, i.e. appuie sur, les feuillets internes jusqu'à l'ouverture du pore de fusion.
Chez la levure, l'insertion de trois complexes SNARE dans une tige au site de fusion produit un pore de 3 nm de diamètre (SNARE-mediated membrane fusion arrests at pore expansion to regulate the volume of an organelle 2018).
2. La fixation de domaines protéiques volumineux aux extrémités C-terminales luminales des protéines SNARE arrête la fusion membranaire dans un état d'hémifusion (Steric hindrance of SNARE transmembrane domain organization impairs the hemifusion-to-fusion transition 2016).
Rôle des TDM des SNARE
1. L'indentation induite par le TMD comprime la tige, i.e. elle réduit la distance entre les deux feuillets luminaux (épaisseur de la tige), et simultanément l'élargit parallèlement aux surfaces membranaires.
(Figure : vetopsy.fr d'après D'Agostino et coll)
La nature hydrophile et la charge nette des C-terminaux permettent l'indentation de la tige, car ils s'opposent à la transition des C-terminaux dans le noyau hydrophobe de la membrane, qui, sinon, perforerait la bicouche.
2. Les étiquettes volumineuses interfèrent avec le regroupement de plusieurs C-terminaux dans une petite région.
En biologie moléculaire, une étiquette, ou un tag, est une courte séquence d'acides aminés, parfois d'acides nucléiques, qui est ajoutée à une protéine pour étudier son effet.
Plusieurs domaines C-terminaux des SNARE agissent collectivement sur un petit patch pour :
- déformer le feuillet interne membranaire,
- réduire progressivement l'épaisseur de la tige,
- rapprocher la tige de la barrière de l'ouverture des pores jusqu'à ce qu'une fluctuation thermique suffisante permette le franchissement brutal de cette barrière.
L'attachement de grandes étiquettes peptidiques hydrophiles aux extrémités C-terminales des SNARE rend la pénétration membranaire très coûteuse et hautement improbable.

La fusion ne reposerait pas sur la perforation membranaire par les extrémités C-terminales, mais impliquerait plutôt une indentation et un remodelage associé des membranes (
3. Des altérations chimiques et des substitutions aux extrémités C-terminales du TMD (Role of the transmembrane domain in SNARE protein mediated membrane fusion: peptide nucleic acid/peptide model systems 2016) :
- retardent la fusion lorsque l'hydrophobie des extrémités C-terminales est diminuée,
- accélère la fusion lorsque l'hydrophobicité est augmentée.

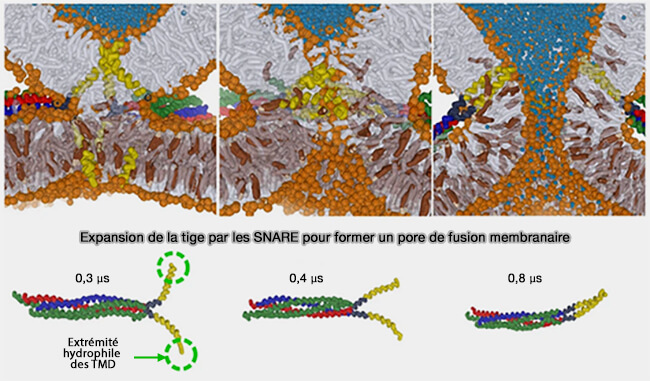
Chez la levure, le complexe SNARE seul conduit qu'à l'hémifusion.
(Figure : vetopsy.fr d'après Risselada et coll)

La présence de grosses protéines associées aux SNARE facilite la fusion.
Rôles des protéines de liaison aux SNARE
dans la formation du pore
Biologie cellulaire et moléculaireConstituants de la celluleTransport membranaireTransports sans mouvements membranairesTransports passifsTransports actifsTransports avec mouvements membranaires : trafic vésiculaireFusion/fission membranaireEndocytoseVoie sécrétoireCanaux ioniquesTransporteursUniportsPompesCo-transporteursMoteurs moléculairesVoies de signalisation


