Transport membranaire
Transports sans mouvements membranaires
Transporteurs actifs : co-transporteurs (transporteurs secondaires)
Modèle rocking-bundle : sites de liaisons aux ions et portes
- Biologie cellulaire et moléculaire
- Constituants de la cellule
- Matrice extracellulaire
- Reproduction cellulaire
- Transport membranaire
- Moteurs moléculaires
- Voies de signalisation

Le modèle rocking-bundle (faisceau à bascule) des co-transporteurs, la liaison du substrat et des ions dans un site central entre deux domaines structurellement distincts, provoque le mouvement de couplage entre les portes extérieures et intérieures.
Site de liaison aux ions
1. Pour LeuT, la conformation vers l'extérieur est stabilisée par la liaison à un ion Na+ (Ion/substrate-dependent conformational dynamics of a bacterial homolog of neurotransmitter:sodium symporters 2010).
-
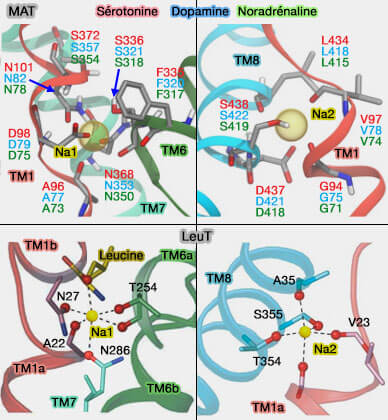
Site de liaison aux ions (MAT et LeuT)
(Figure : vetopsy.fr d'après Grouleef et coll et Piscitelli)
a. Ce site de sodium, appelé Na2, est situé sur la région flexible (non hélicoïdale) de TM1 dans le domaine central, et TM8 dans le domaine d'échafaudage.
Na2 est conservé dans tous les transporteurs à repliement LeuT dépendant de Na+ (Alternating-access mechanism in conformationally asymmetric trimers of the betaine transporter BetP 2012).
b. Un autre site non conservé (Na1) dans le domaine central est formé par des chaînes latérales de résidus sur les TM1b, 6a et 7, et par l'acide aminé du substrat (Crystal structure of a bacterial homologue of Na+/Cl--dependent neurotransmitter transporters 2005).
2. Pour les transporteurs de monoamine (MAT), une source d'énergie est nécessaire pour faciliter le transport des substrats de monoamine à travers la membrane contre leur gradient électrochimique (driving force), vu leurs concentrations élevées à l'intérieur des neurones.
- Pour les trois MAT, le transport du substrat est couplé au co-transport des ions Na+ et Cl- suivant leur gradient de concentration, tandis que hSERT nécessite également le contre-transport des ions K+.
- La stoechiométrie de transport, substrat/Na+/Cl-/K+ semble être de 1:1:1:1 (hSERT), 1:1:1:0 (hNET) et 1:2:1:0 (hDAT).
- Les sites Na1, Na2 et Cl ont été identifiés, mais pas le site K.
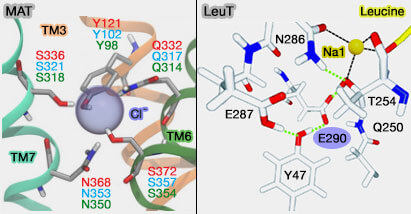
(Figure : vetopsy.fr d'après Grouleef et coll et Forrest)
La géométrie de coordination observée dans les sites de liaison des ions Na+ change quelque peu entre les structures de LeuT et dDAT, i.e. des différences subtiles dans la géométrie de coordination des ions Na+ entre les MAT pourrait influencer leur fonctionnement.
3. LeuT est un transporteur indépendant de Cl-, i.e il ne contient pas de site de liaison aux ions Cl-.
Toutefois, la chaîne latérale du résidu E290 dans LeuT chevauche la position du site de liaison aux ions Cl- dans les transporteurs de neurotransmetteurs humains (Identification of a chloride ion binding site in Na+/Cl−-dependent transporters 2007 et Mechanism of chloride interaction with neurotransmitter:sodium symporters 2007).
Portes extra- et intracellulaire
Porte extracellulaire
Cette porte est appelée " porte mince (thin gate) " par opposition à la " porte épaisse (thick gate) " du côté intracellulaire de la conformation occluse extérieure.
LeuT
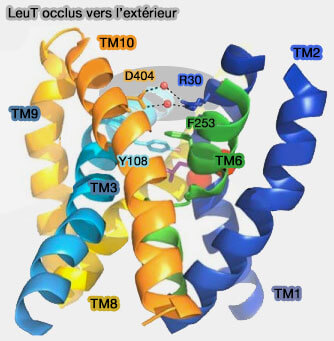
(Figure : vetopsy.fr)
Dans LeuT, il existe un important pont salin conservé sur le plan évolutif qui se forme au cours du blocage de la porte extracellulaire (Crystal structure of a bacterial homologue of Na+/Cl−-dependent neurotransmitter transporters 2005 et X-ray structures of LeuT in substrate-free outward-open and apo inward-open states 2012).
- Dans la conformation occluse vers l'extérieur de LeuT, l'accès au site est bloqué en partie par un pont salin aqueux formé par Arg30 dans TM1 et un Asp404 dans TM10.
- Dans la conformation tournée vers l'extérieur, le pont salin Arg30/Asp-404 est brisé, ce qui entraîne l'exposition du site de liaison au substrat à l'environnement aqueux extracellulaire.
- Dans la conformation tournée vers l'intérieur, l'interaction ionique est directe sans molécule d'eau.
Remarque : dans les transporteurs MFS (Major Facilitator Superfamily) dont le mécanisme est le rocker-switch, les ponts de sel interfaisceaux doivent être brisés, et parfois reformés, pour faciliter les réarrangements globaux.
MAT
Dans les membres des récepteurs NSS (Neurotransmitter Sodium Symporter) des mammifères, et en particulier les MAT (MonoAmine Transporter), cet alignement est conservé (A Comprehensive Structure-Based Alignment of Prokaryotic and Eukaryotic Neurotransmitter/Na+ Symporters (NSS) Aids in the Use of the LeuT Structure to Probe NSS Structure and Function 2006).
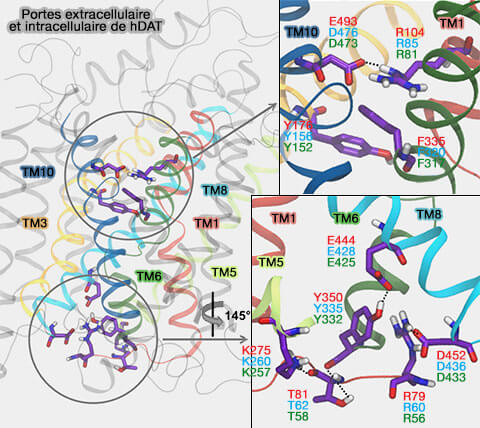
(Figure : vetopsy.fr d'après Grouleef et coll)
La porte extracellulaire est formée de deux couches.
1. Dans DAT, Arg85 dans TM1 et Asp476 dans TM10 forment une porte " mince " comme dans LeuT, essentielle pour la translocation du substrat et pour la stabilisation du site de liaison (A Conserved Salt Bridge between Transmembrane Segments 1 and 10 Constitutes an Extracellular Gate in the Dopamine Transporter 2014).
2. La seconde couche, constituée par F320 et Y156 (avec F155 et W84), forme un couvercle hydrophobe directement au-dessus du site de liaison primaire.
En outre, dans DAT, R60 forme un pont salin avec D436.
3. Le résidu Y335, au centre du vestibule intérieur et au sommet de TM7, est aussi essentiel pour le transport.
La mutation Y335A abolit complètement l'absorption de DA et transforme le transporteur en canal, i.e. la mutation inhibe le retour à la conformation ouverte vers l'extérieur (Generation of an activating Zn2+ switch in the dopamine transporter: Mutation of an intracellular tyrosine constitutively alters the conformational equilibrium of the transport cycle 2002).
Des molécules d'eau pénètrent dans le vestibule intérieur fermé jusqu'à ce qu'il atteigne Y335, ce qui suggère que ce résidu peut jouer un double rôle en :
- stabilisant la conformation tournée vers l'extérieur,
- formant la partie hydrophobe de la barrière interne.
(Figure : vetopsy.fr d'après Stockner et coll)
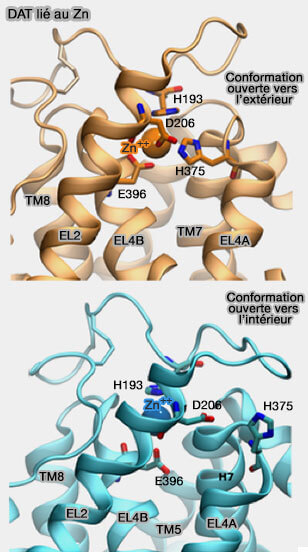
4. Les mouvements des boucles extracellulaires EL2 et EL4 sont associés au passage d'une conformation ouverte vers l'extérieur à celle ouverte vers l'intérieur (Mutational Analysis of the High-Affinity Zinc Binding Site Validates a Refined Human Dopamine Transporter Homology Model 2013).
4. Chez DAT, et uniquement chez lui, la liaison du Zn++ sur H193, D206, H375 et E396 limite le mouvement du transporteur pendant le mécanisme du rocker-bundle.
Fait unique chez les MAT, le zinc stabilise la conformation ouverte vers l'extérieur et inhibe le transport du substrat.
a. EL2, plus longue que celle de LeuT de 21 résidus, est constitué de plusieurs segments :
- une boucle, qui comprend un pont disulfure entre C180 et C189 et H193,
- l'hélice EL2 au centre de la boucle extracellulaire, hautement conservée.
b. La partie hélicoïdale N-terminale de EL4, proche de EL2, contient D206, H375 et E396 se déroule lorsque la dopamine (DA) est liée à son récepteur (Molecular dynamics of leucine and dopamine transporter proteins in a model cell membrane lipid bilayer 2010).
Porte intracellulaire
La porte intracellulaire doit s'ouvrir pour permettre la libération du substrat et des ions dans le milieu intracellulaire (
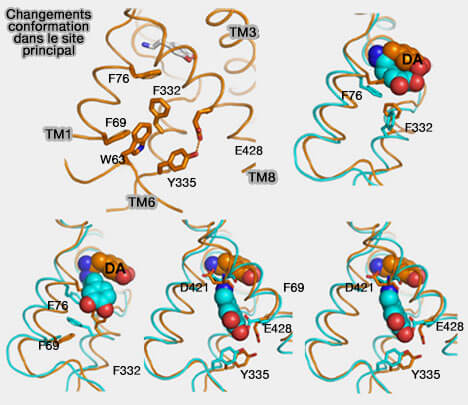
1. Plusieurs études ont montré que les résidus suivants dans DAT forment un amas hydrophobe juste en dessous du site de liaison primaire.
- F76, F69 et F332 (The Substrate-Driven Transition to an Inward-Facing Conformation in the Functional Mechanism of the Dopamine Transporter 2011),
- Y335 (cf. au-dessus) et W63 Conformational changes in dopamine transporter intracellular regions upon cocaine binding and dopamine translocation 2014).
(Figure : vetopsy.fr d'après Shan et coll)
Ces résidus hydrophobes s'éloignent les un des autres pour permettre à la dopamine de passer de son site de liaison vers le cytoplasme.
- La rotation de F332 pousse F69 vers TM1a.
- L'éloignement de TM1a de TM6b et du centre de la protéine permet l'ouverture du système de déclenchement.
2. D'autres liaisons entre résidus semblent intervenir.
a. T62/K260, T62/Y335 lient efficacement TM1 et TM6 ensemble par des interactions avec l'extrémité N-terminale, pour stabiliser pendant 16 ns la conformation ouverte vers l'extérieur (An Intracellular Interaction Network Regulates Conformational Transitions in the Dopamine Transporter 2008)
K65/N340, reliant ainsi TM1 à TM7, interviendraient aussi dans la conformation ouverte vers l'extérieur.
b. La liaison Y335/E428, dans TM6 et TM8, respectivement, est rompue lors de la rotation de Y335 lors du changement de la conformation ouverte vers l'extérieur à celle ouverte l'intérieur, comme, par ailleurs, Y350/E444.
c. L'extrémité N-terminale de TM1a et la boucle intracellulaire directement après TM8 (IL4, D436 et D452), sont reliées par une interaction saline dans les conformations ouvertes vers l'extérieu, et sont séparées au cours de la transition vers la conformation ouverte vers l'intérieur (Neurotransmitter and psychostimulant recognition by the dopamine transporter 2015).
Mécanisme du rocker-bundle
Biologie cellulaire et moléculaireConstituants de la celluleMatrice extracellulaireReproduction cellulaireTransport membranaireCanaux ioniquesTransporteursUniportsPompesCo-transporteursMécanismes des transporteursRocker-switchRocking-bundleElevatorTrafic vésiculaireMoteurs moléculairesVoies de signalisation


