Transport membranaire
Transports sans mouvements membranaires
Transporteurs actifs : co-transporteurs (transporteurs secondaires)
Modèle elevator (ascenseur) : structure de transporteurs
- Biologie cellulaire et moléculaire
- Constituants de la cellule
- Matrice extracellulaire
- Reproduction cellulaire
- Transport membranaire
- Moteurs moléculaires
- Voies de signalisation

Le modèle elevator (" ascenseur ou élévateur ") est l'un des trois mécanismes des co-transporteurs.
1. La plupart des co-transporteurs peuvent être décrits comme fonctionnant sous :
- le modèle rocker-switch (" commutateur ou interrupteur à bascule "), le plus simple,
- le modèle rocking-bundle (" faisceau à bascule ").
2. Le modèle elevator (" ascenseur ou élévateur ") a été envisagé plus récemment.
Vue d'ensemble du modèle de l'ascenseur

Dans le modèle d'ascenseur, le site de liaison au substrat est situé en grande partie ou en totalité dans un seul domaine qui se déplace à travers la membrane alors que le domaine d'échafaudage reste relativement rigide et immobile.
Ces transporteurs, dimériques ou trimériques pour la plupart, sont constitués de deux domaines comme les transporteurs à modèle rocker-bundle.
(Figure : vetopsy.fr d'après Verdon et coll)
1. Le domaine d'échafaudage est utilisé pour l'oligomérisation.
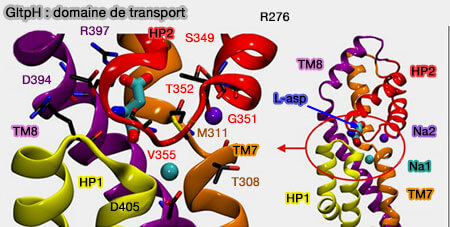
2. Le domaine de transport (ou noyau), situé en périphérie et comportant un site de liaison et deux portes, subit une translation verticale et une rotation par rapport au domaine d'échafaudage, et donc de la membrane (
- La porte extramembranaire ouverte, le substrat se fixe sur son site de liaison, en général en coopération avec des liaisons ioniques (Na+ par exemple).
- La porte extramembranaire se ferme.
- Le domaine subit une translocation verticale et une rotation pour transporter le substrat à travers la membrane, en restant rigide (Crystal structures reveal the molecular basis of ion translocation in sodium/proton antiporters 2016).
- La libération du substrat et des ions s'effectue dans le milieu intramembranaire.
- Le domaine de transport remonte pour retrouver sa place en partie extramembranaire, d'où le terme d'ascenseur (elevator en anglais).
Deux cas peuvent se présenter :
- ou l'ascenseur remonte vide (comme VcINDY par exemple),
- ou l'ascenseur remonte en emportant un ion ou un substrat selon une configuration d'antiport (comme NapA par exemple).
La grande différence avec le rocking-bundle est que le transport n'est pas réalisé uniquement par le réarrangement de la protéine autour du site de liaison au substrat.
Structure des transporteurs
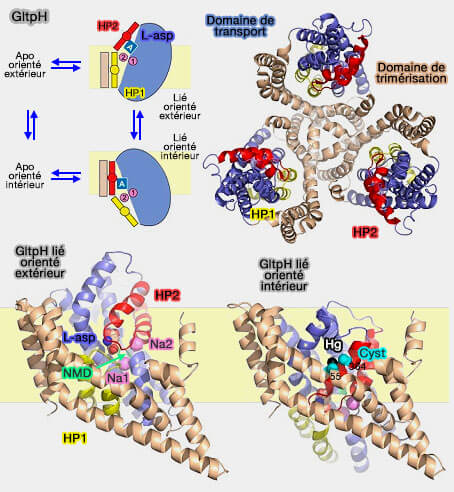
La première structure découverte qui utilisait ce mécanisme fut celle d'un homologue des transporteurs de glutamate de Pyrococcus horikoshii, le symporteur de sodium-aspartate GltPh.
Les transporteurs de glutamate, ou transporteurs d'acides aminés excitateurs (EAAT), sont localisés dans les membranes plasmiques des cellules gliales et des neurones, dans lesquelles ils participent à la recapture du glutamate et aspartate (L-asp).
(Figure : vetopsy.fr d'après Vergara-Jaque et coll)
Puis, on a découvert bien d'autres transporteurs utilisant le même modèle de transport.
GltPh
Vue d'ensemble
Le symporteur de sodium-aspartate GltPh, trimérique, est composé par (Transport mechanism of a bacterial homologue of glutamate transporters 2009) :
- un domaine d'échafaudage central trimérisé, qui ancre le transporteur à la membrane.
- trois domaines de transport périphériques.
Lors de la liaison des ions et du substrat, les domaines de transport subissent un mouvement vertical de 16 Å et une rotation de 37º par rapport au domaine d'échafaudage qui reste sensiblement fixe pour libérer la cargaison dans l'espace intramembranaire.
La structure fine de GltPh comprend :
- huit domaines transmembranaires, TM1-TM8,
- deux épingles à cheveux (hairpin) réentrantes hélicoïdales, HP1 et HP2.
Contrairement à la plupart des transporteurs, GltPh contient deux paires de répétitions structurellement inversées TM1-3/TM4-6 et HP1-TM7/HP2-TM8.
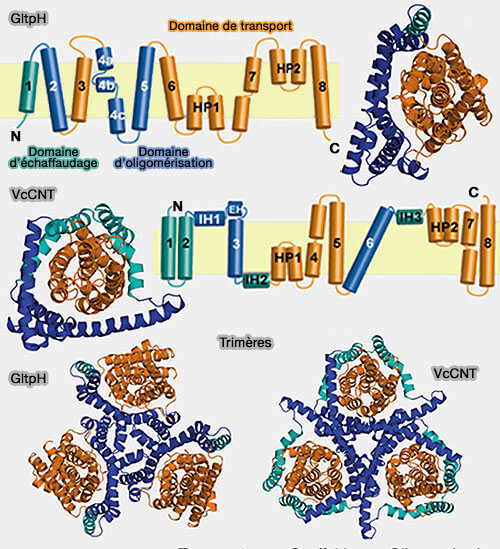
Domaine d'échafaudage
Le domaine d'échafaudage trimérique est formé par les TM1-2 et TM4-5 de chaque sous-unité.
- Ces deux motifs rappellent le domaine d'échafaudage des transporteurs à repliement LeuT.
- Le dessin ci-contre fait une distinction entre TM1, domaine d'échafaudage strict, et TM2/TM4/TM5, domaine d'oligomérisation.
(Figure : vetopsy.fr d'après Zomot et coll)
1. TM2 et TM5, fortement inclinés, entrent en interaction avec le domaine de transport dans les deux conformations, orientée vers l'extérieur et orientée vers l'intérieur : cette surface d'interaction enterrée est hydrophobe.
Ce motif à deux hélices se retrouve dans les ATPases à moteur rotatif, où ces hélices forment une barrière hydrophobe entre deux demi-canaux qui transportent les ions (H+ ou Na+) pendant la translocation du substrat (
2. Le domaine d'échafaudage forme une barrière entre les régions aqueuses extracellulaires et intracellulaires, dont la largeur est bien plus faible que la bicouche lipidique, quelquefois 14 résidus seulement (A two-domain elevator mechanism for sodium/proton antiport 2013).
- Le domaine de transport est donc inséré dans la membrane et forme une sorte de cuvette remplie du milieu aqueux, extra- ou intracellulaire suivant la conformation du transporteur.
- Le site de liaison au substrat du domaine de transport ne doit donc pas traverser toute la membrane et la translocation du substrat ne nécessite que des réarrangements modestes, sans traverser une épaisse couche protéique comme dans les autres transporteurs.
La membrane doit s'adapter en raison de l'hydrophobie du domaine d'échafaudage et l'eau doit entrer avec le substrat.
3. Dans les NapA et MjNhaPl, la surface externe du domaine d'échafaudage est chargée négativement, ce qui aide probablement à sélectionner et à concentrer son substrat lorsqu'il traverse la surface vers son site de liaison (Structure and transport mechanism of the sodium/proton antiporter MjNhaP1 2014).
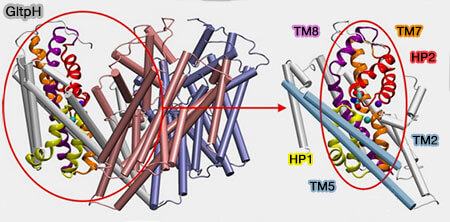
Domaine de transport
Le domaine de transport, de forme compacte et cylindrique, est formé par les domaines TM3/TM6 et HP1-TM7/HP2-TM8 qui contiennent des régions flexibles, i.e. déroulées, qui servent de site de liaison au substrat.
(Figure : vetopsy.fr d'après Zomot et coll)
1. Les domaines TM3/TM6 forment l'arrière hydrophobe du domaine de transport qui fait toujours face aux lipides membranaires.
2. HP1/HP2, avec les demi-hélices N-terminales de TM7/TM8, forment la surface antérieure relativement polaire du domaine de transport.
- HP1-TM7 sont principalement exposés à l'échafaudage ou au milieu intracellulaire.
- HP2-TM8 sont confrontés à l'échafaudage ou à la solution extracellulaire.
HP2 sert de porte et de site de liaison pour enserrer le substrat et les ions dans une configuration occluse (Intracellular Gating in an Inward-facing State of Aspartate Transporter GltPh Is Regulated by the Movements of the Helical Hairpin HP2 2013). Le rôle de HP1 est plus obscur (
3. Le domaine de transport est attaché au domaine d'échafaudage par des boucles labiles et des hélices qui facilitent ses mouvements.
4. Les résidus essentiels à la reconnaissance et à la liaison du substrat et des deux sites de liaison au Na+ (Na1 et Na2) sont contenus dans le domaine de transport.
Un motif Asn310-Met311-Asp312 (NMD) non hélicoïdal hautement conservé interrompt TM7 et est impliqué dans la liaison des ligands (A Conserved Methionine Residue Controls the Substrate Selectivity of a Neuronal Glutamate Transporter 2010).
- L'oxygène carbonyle de la chaîne principale de Asn310 contribue au site Na1.
- La chaîne latérale de Met311 fait saillie entre le substrat, les sites de liaison Na1 et Na2.
Autres transporteurs
Nous ne pouvons pas décrire toutes les configurations possibles des transporteurs à mécanisme d'ascenseur.
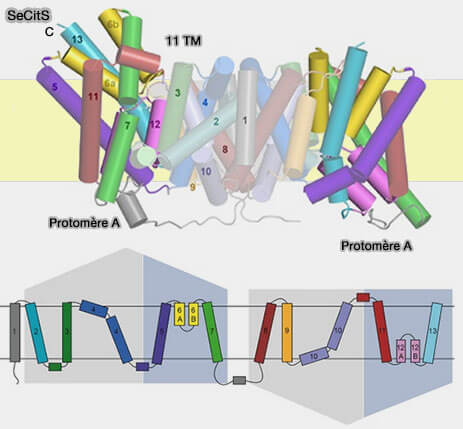
(Figure : vetopsy.fr d'après Wöhlert et coll)
Plusieurs autres transporteurs, plus ou moins proches structurellement ou sans lien évident, fonctionnent selon ce principe. C'est le cas par exemple :
1. les antiports Na+/H+ NhaA d'Escherichia coli (Crystal structure of the sodium–proton antiporter NhaA dimer and new mechanistic insights 2014), NapA de Thermus thermophilus (A two-domain elevator mechanism for sodium/proton antiport 2013), PaNhaP de Pyrococcus abyssi (Structure and substrate ion binding in the sodium/proton antiporter PaNhaP 2014), MjNhaP1 de Methanocaldococcus jannaschii (Structure and transport mechanism of the sodium/proton antiporter MjNhaP1 2014) ;
2. les transporteurs d'acides biliaires (Structural basis of the alternating-access mechanism in a bile acid transporter 2014) ;
3. le transporteur Na+/succinate VcINDY de Vibrio cholerae (The bacterial dicarboxylate transporter, VcINDY, uses a two-domain elevator-type mechanism 2016 et Structure and mechanism of a bacterial sodium-dependent dicarboxylate transporter 2016) ;
4. les transporteurs d'ascorbate (Crystal structure of a phosphorylation-coupled vitamin C transporter 2015) et de saccharide (Crystal structure of a phosphorylation-coupled saccharide transporter 2011) couplés à la phosphorylation ;
5. le symporteur Na+/nucléoside vcCNT (Repeat-swap homology modeling of secondary active transporters: updated protocol and prediction of elevator-type mechanisms 2015) ;
6. les transporteurs p-aminobenzoyl-glutamate AbgT, utilisés pour la synthèse d'acide folique, la vitamine B9 (Structure and function of Neisseria gonorrhoeae MtrF illuminates a class of antimetabolite efflux pumps 2015)
7. du symporteur Na+/citrate SeCitS de Salmonella enterica (Mechanism of Na+-dependent citrate transport from the structure of an asymmetrical CitS dimer 2015)…
Mécanisme du transport
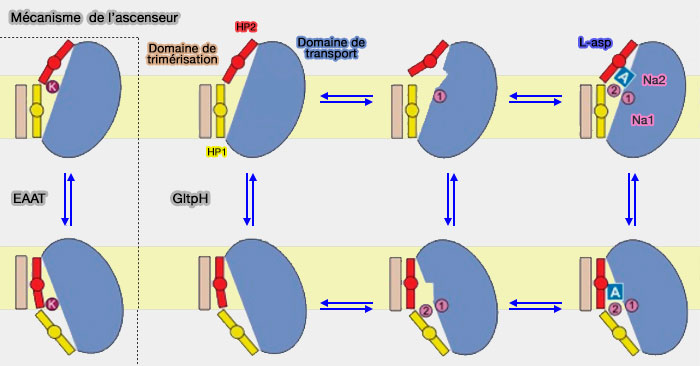
(Figure : vetopsy.fr d'après Verdon et coll)
Biologie cellulaire et moléculaireConstituants de la celluleMatrice extracellulaireReproduction cellulaireTransport membranaireCanaux ioniquesTransporteursUniportsPompesCo-transporteursMécanismes des transporteursRocker-switchRocking-bundleElevatorTrafic vésiculaireMoteurs moléculairesVoies de signalisation


