Transport membranaire
Transports sans mouvements membranaires
Transporteurs actifs : co-transporteurs (transporteurs secondaires)
Modèle rocking-bundle : vue d'ensemble
- Biologie cellulaire et moléculaire
- Constituants de la cellule
- Matrice extracellulaire
- Reproduction cellulaire
- Transport membranaire
- Moteurs moléculaires
- Voies de signalisation

Le modèle rocking-bundle (faisceau à bascule) est l'un des trois mécanismes des co-transporteurs.
1. La plupart des co-transporteurs peuvent être décrits comme fonctionnant sous :
- le modèle rocker-switch (" commutateur ou interrupteur à bascule "), le plus simple,
- le modèle rocking-bundle (" faisceau à bascule ").
2. Le modèle elevator (" ascenseur ou élévateur ") a été envisagé plus récemment.
Vue d'ensemble du mécanisme à bascule (rocking-bundle)
Dans le mécanisme rocking-bundle (faisceau à bascule ou tout simplement, à bascule), la liaison du substrat et des ions dans un site central entre deux domaines structurellement distincts provoque le mouvement de couplage entre les portes extérieures et intérieures (The Rocking Bundle: A Mechanism for Ion-Coupled Solute Flux by Symmetrical Transporters 2009).
1. Le symporteur d'acide aminé-sodium LeuT, un homologue neurotransmetteur-symporteur de sodium (NSS) d'Aquifex aeolicus, est l'exemple type de ce mécanisme de transport.

Le repliement LeuT se retrouve dans de nombreuses familles, et en particulier dans celles des transporteurs de neurotransmetteurs (22 % d'homologie).

(Figure : vetopsy.fr d'après Grouleef et coll)
Les régions les plus conservées entre LeuT et les récepteurs NSS (Neurotransmitter Sodium Symporter) des mammifères sont les sites de liaison d'une molécule de leucine et de deux ions Na+.
- Les transporteurs de monoamine humaine (MAT) facilitent la recapture des neurotransmetteurs comme la sérotonine (SERT), la dopamine (DAT) et la noradrénaline ou norépinéphrine (NET) de la fente synaptique par les neurones présynaptiques (Monoamine transporters: insights from molecular dynamics simulations 2015).
- Ces transporteurs utilisent tous le gradient de concentration de Na+ membranaire pour faciliter le transport des neurotransmetteurs.
2. Le déséquilibre dans l'homéostasie des neurotransmetteurs est lié à des maladies comme la dépression majeure, les troubles anxieux, l'hyperactivité avec déficit de l'attention, la schizophrénie, la maladie de Parkinson et l'obésité (SLC6 Neurotransmitter Transporters: Structure, Function, and Regulation 2011).
a. Le traitement de la dépression est axé sur la modulation de la neurotransmission des monoamines, souvent par l'inhibition des MAT (New design strategies for antidepressant drugs 2013).
b. Cela a entraîné le développement :
- des antidépresseurs tricycliques (ATC) ciblant les trois MAT (LeuT-desipramine structure suggests how antidepressants inhibit human neurotransmitter transporters 2007),
- des inhibiteurs sélectifs de la recapture de la sérotonine (ISRS),
- des inhibiteurs de la recapture de la norépinéphrine - IRSN - (LeuT-desipramine structure suggests how antidepressants inhibit human neurotransmitter transporters 2007).
(Figure : vetopsy.fr d'après Grouleef et coll et Yashamita)
En outre, des drogues addictives, notamment la cocaïne et l'amphétamine, se lient également aux MAT, et les transporteurs sont donc également considérés comme des cibles potentielles pour le traitement de la toxicomanie (Monoamine transporters and psychostimulant addiction 2008).

La majeure partie de ce chapitre est tirée de " Monoamine transporters: insights from molecular dynamics simulations (2015) " qui apporte, en outre, une bonne compréhension des mécanismes qui entrent en jeu dans les anxiolytiques et les antidépresseurs.
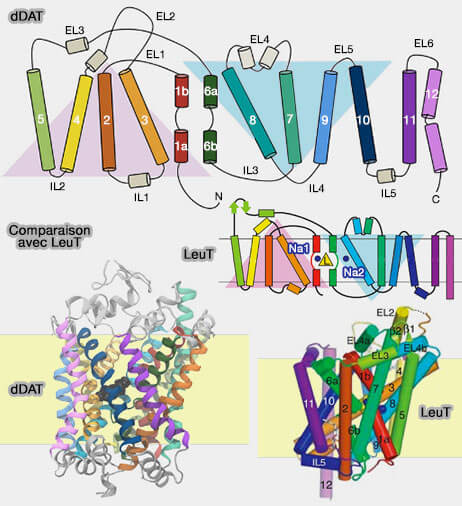
Structure du repliement LeuT
1. Les transporteurs décrits (dDAT, transporteur de la dopamine de la drosophile et LeuT) sont composés de :
- 12 domaines transmembranaires hélicoïdaux (TM1-TM12), dont les 10 premiers forment le repliement LeuT,
- 6 boucles extracellulaires (EL1-EL6 ou EC1-6) et cinq boucles intracellulaires (IL1-IL5 ou IC1-5).
Le feuillet de LeuT est constitué de deux répétitions structurellement inversées de cinq segments de TM (TM 1-5 et TM 6-10) qui s'entrecroisent pour former deux faisceaux distincts (Crystal structure of a bacterial homologue of Na+/Cl−-dependent neurotransmitter transporters 2005 et Mechanism for alternating access in neurotransmitter transporters 2008).
a. Le domaine central, constitué par TM1/TM3, et TM6/TM8, comporte deux hélices antiparallèles et discontinues, TM1 et TM6, qui forment :
- la plus grande partie du site de liaison du substrat,
- les sites de liaison aux ions.
b. Le domaine d'échafaudage qui l'entoure, constitué par TM2/TM4, et TM7/TM9, comprend deux motifs hélicoïdaux en forme de V qui se chevauchent.
(Figure : vetopsy.fr d'après Stockner et coll)
c. Le domaine d'échafaudage et le domaine central noyau sont liés par les hélices TM5 et TM10.
- L'échafaudage complet (TM3-5, TM8-10) est stationnaire.
- L'axe de symétrie de l'ensemble est parallèle à la membrane, contrairement aux rocker-switch (Structural symetry in membrane proteins 2015).
2. Contrairement à leurs homologues bactériens, les MAT (transporteurs de monoamine) des eucaryotes comportent certaines différences, en particulier entre DAT (transporteur de la dopamine) et LeuT (X-ray structure of the dopamine transporter in complex with tricyclic antidepressant 2013).
- L'homologie n'est que de 22 % environ.
- Leurs extrémités C- et N-terminales, ainsi que la boucle EL2, sont bien plus longues (
porte extracellulaire des MAT).
- Des sites de phosphorylation et de modifications post-traductionnelles sont présents, ce qui n'est pas le cas des procaryotes (SLC6 Transporters: Structure, Function, Regulation, Disease Association and Therapeutics 2013 - SLC : solute carrier -).
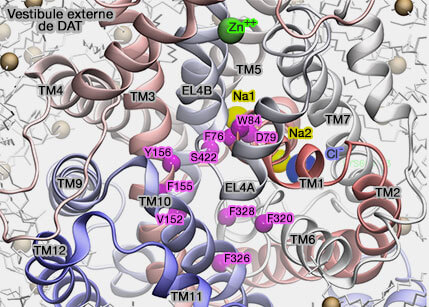
Sites de liaison au substrat
Diverses conformations du repliement LeuT ont été révélées (X-ray structures of LeuT in substrate-free outward-open and apo inward-open states 2012 et Neurotransmitter and psychostimulant recognition by the dopamine transporter 2015).
Le mécanisme de bascule (rocking-bundle) est proposé comme suit.
- L'échafaudage complet (TM3-5, TM8-10) est stationnaire.
- Les hélices du domaine central se déplacent d'avant en arrière, i.e. le site de liaison central alterne entre une conformation ouverte vers l'extérieur (outward-open ou outward-facing) et une conformation ouverte vers l'intérieur (inward-open ou inward-facing).
(Figure : vetopsy.fr d'après Grouleef et coll et Piscitelli)
En outre, la liaison d'un second substrat (ici le Na+) dans un site de liaison du vestibule extracellulaire est nécessaire pour déclencher la libération du substrat du site de liaison primaire au milieu intracellulaire (The Mechanism of a Neurotransmitter:Sodium Symporter—Inward Release of Na+ and Substrate Is Triggered by Substrate in a Second Binding Site 2008 et The Substrate-Driven Transition to an Inward-Facing Conformation in the Functional Mechanism of the Dopamine Transporter 2011).
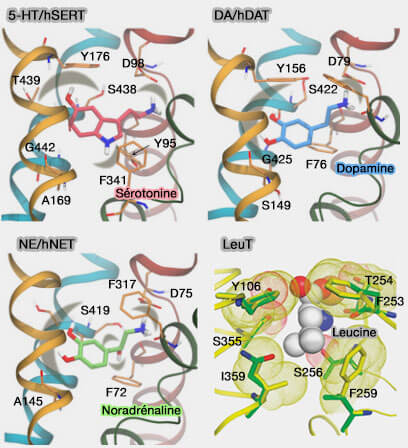
Site de liaison primaire
du substrat (S1)
Les interactions de liaison avec les substrats sont formées par des ponts salins, comme dans les transporteurs MFS : ces ponts sont brisés et reformés pour les changements conformationnels pour faciliter les réarrangements globaux (Salt bridge dynamics control substrate-induced conformational change in the membrane transporter GlpT 2008).
- En outre, des ponts salins peuvent bloquer l'ouverture du côté extracellulaire (
porte extracellulaire et porte intracellulaire).
- D'autre part, un site de liaison supplémentaire pourrait intervenir dans le fonctionnement de ces transporteurs (cf. plus bas).
1. Des structures de LeuT peuvent être liées avec d'autres acides aminés que la leucine, i.e. l'alanine, la glycine, la méthionine, la tyrosine sont liées de manière presque identique (A Competitive Inhibitor Traps LeuT in an Open-to-Out Conformation 2008).
(Figure : vetopsy.fr d'après Zou et coll)
La structure LeuT-tryptophane est quelque peu différente.
- Bien que le tryptophane soit situé dans la même poche de liaison, son plus grand volume implique une conformation de la protéine plus ouverte, fournissant un chemin continu du milieu extracellulaire au site de liaison (Insights into transport mechanism from LeuT engineered to transport tryptophan 2011).
- Il agit comme un inhibiteur compétitif du transport de la leucine et de l'alanine, mais n'est pas transporté lui-même.
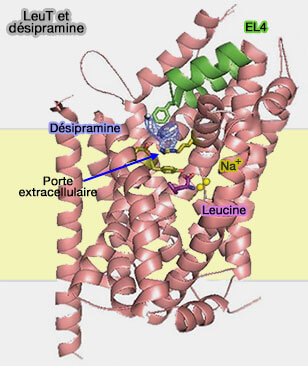
2. Contrairement à l'inhibition compétitive par le tryptophane, les antidépresseurs tricycliques inhibent la LeuT de façon non compétitive (Antidepressant binding site in a bacterial homologue of neurotransmitter transporters 2007).
a. Cette inhibition non compétitive a été révélée dans une série de structures cristallines contenant à la fois de la leucine et un antidépresseur lié à LeuT (LeuT-desipramine structure suggests how antidepressants inhibit human neurotransmitter transporters 2007).
Le site du substrat est occupé par la leucine, tandis que la molécule antidépressive est liée dans la voie menant à S1 site leucine, i.e. inhibant la fermeture de la voie extracellulaire, et donc l'ouverture postérieure de la voie intracellulaire (
(Figure : vetopsy.fr d'après Grouleef et coll)
b. On retrouve ces processus dans les MAT (The High-Affinity Binding Site for Tricyclic Antidepressants Resides in the Outer Vestibule of the Serotonin Transporter 2010).
2. La rupture et la reformation des interactions ioniques entre les résidus dans les régions cytoplasmiques de TM1 et d'échafaudage TM8 sont également considérées comme étant la clé de la fonction des transporteurs NSS.
Les substrats portent une charge positive (sur leur amine primaire pour les MA) lorsqu'ils sont transportés et sont donc capables de former un pont salin avec des résidus chargés négativement présents dans le site de liaison.
- Dans les trois sites de liaison, la majorité des résidus sont hydrophobes.
- Toutefois, quelques résidus polaires sont capables de former des interactions plus fortes avec les substrats (Comparative Modeling of the Human Monoamine Transporters: Similarities in Substrate Binding 2013), une caractéristique qui peut être exploitée lors de la conception de ligands sélectifs.
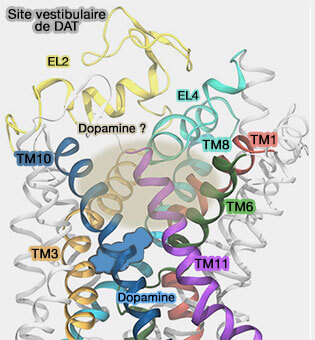
Site vestibulaire de liaison du substrat (S2)
Un site vestibulaire du substrat a été décrit pour LeuT et les MAT (To be, or not to be two sites: that is the question about LeuT substrate binding 2011 et Identification of a Second Substrate-binding Site in Solute-Sodium Symporters 2014).
La liaison d'un second substrat dans le vestibule extracellulaire est-elle nécessaire pour déclencher la libération du substrat du site de liaison primaire (
Sites de liaison aux ions et portes extra- et intracellulaires
Biologie cellulaire et moléculaireConstituants de la celluleMatrice extracellulaireReproduction cellulaireTransport membranaireCanaux ioniquesTransporteursUniportsPompesCo-transporteursMécanismes des transporteursRocker-switchRocking-bundleElevatorTrafic vésiculaireMoteurs moléculairesVoies de signalisation


