Transport membranaire
Transports sans mouvements membranaires
Transporteurs actifs : co-transporteurs (transporteurs secondaires)
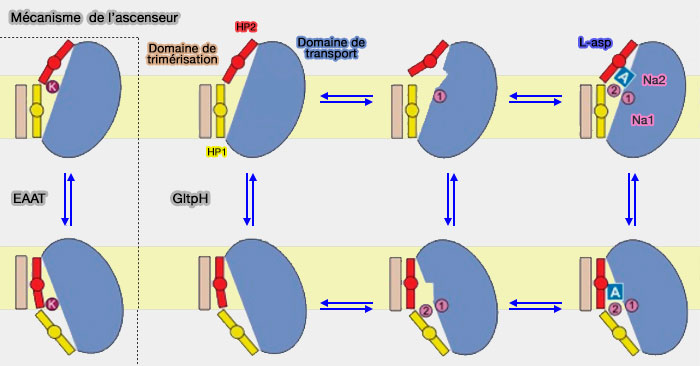
Modèle elevator (ascenseur) : mécanisme
- Biologie cellulaire et moléculaire
- Constituants de la cellule
- Matrice extracellulaire
- Reproduction cellulaire
- Transport membranaire
- Moteurs moléculaires
- Voies de signalisation

Dans le modèle d'ascenseur, le site de liaison au substrat est situé en grande partie ou en totalité dans un seul domaine (domaine de transport) qui se déplace à travers la membrane alors que le domaine d'échafaudage reste relativement rigide et immobile.
Les événements qui déclenchent le mécanisme n'ont pas encore été résolus. On ne connaît, pour l'instant, que :
- la conformation orientée vers l'extérieur de GltPh,
- la conformation orientée vers l'intérieur de SeCitS (Mechanism of Na+-dependent citrate transport from the structure of an asymmetrical CitS dimer 2015).

Le mécanisme décrit ci-dessous est essentiellement basé sur celui de GltPh, décrit dans Coupled ion binding and structural transitions along the transport cycle of glutamate transporters (2014).
Conformations du transporteur apo et lié
1. Le domaine de transport apo, sans substrat, a une structure identique lorsqu'il fait face vers l'extérieur ou vers l'intérieur.
- Les sites de liaison du ligand sont déformés, mais le domaine reste compact, ce qui suggère qu'il se déplace à travers la membrane comme un corps rigide.
- Les domaines apo sont obtenus par la mutation R397A pour la conformation ouverte vers l'extérieur et la mutation K55C-A364C piégée dans l'état tourné vers l'intérieur lors de la réticulation avec le mercure.
2. Lors de la liaison au substrat et aux ions, le domaine reste aussi rigide (Transport mechanism of a bacterial homologue of glutamate transporters 2009).
(Figure : vetopsy.fr d'après Verdon et coll)
3. Les liaisons ioniques provoquent des changements structuraux à l'origine de la forte coopérativité de Na+ et de la liaison au substrat, qui serait l'un des principaux mécanismes de couplage (Binding thermodynamics of a glutamate transporter homologue 2013).
- La liaison ionique au site Na1, situé en profondeur dans le noyau du domaine de transport, déclenche des changements structurels qui sont propagés à la porte extracellulaire HP2, au moins en partie, par la chaîne latérale de Met311 dans le motif NMD.
- Par conséquent, HP2, qui est replié dans la forme apo dans la liaison au substrat et dans les sites Na2, libère les sites.
Chez GltPh, les domaines de transport subissent un mouvement vertical de 16 Å et une rotation de 37º par rapport au domaine d'échafaudage qui reste sensiblement fixe lors du transport du substrat vers l'espace intramembranaire.
Site de liaison au substrat
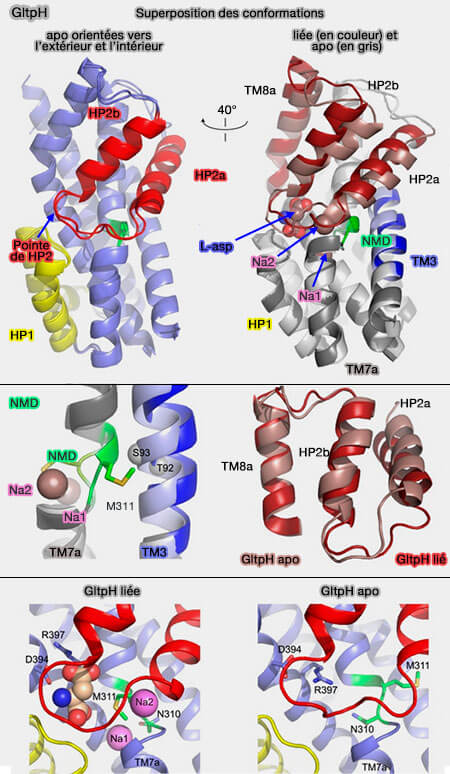
Tous les sites de liaison au ligand connus sont déformés sous les formes apo par rapport à la forme liée.
(Figure : vetopsy.fr d'après Verdon et coll)
Lorsqu'il est lié aux ions et au substrat, GltPh-R397A cristallise dans la configuration ouverte vers l'extérieur, similaire à la structure rapportée pour un homologue proche GltPh (Crystal structure of a substrate-free aspartate transporter 2013).
Les différences conformationnelles entre les formes entièrement liées et apo du domaine de transport sont les suivantes :
1. un mouvement concerté de HP2 et TM8a, qui forment la surface extracellulaire du domaine ;
2. des réarrangements locaux aux sites de liaison de ligand, impliquant HP2, le motif NMD et TM3.
a. Dans HP2, le dernier tour hélicoïdal de HP2a se déroule, et HP2a, avec la région de boucle à l'extrémité HP2, s'enfonce dans le substrat et les sites de liaison de Na2.
b. Dans le motif NMD (Asn310-Met311-Asp312),
- la chaîne latérale de Asn310 s'éloigne de TM3 et remplit partiellement le site Na1 vide,
- la chaîne latérale de Met311 subit un mouvement inverse, s'éloignant des sites de liaison.
c. TM3 se détourne du motif NMD, en particulier autour de Thr92 et Ser93.
Notamment, ces résidus associés à la chaîne latérale d'Asn310 formeraient le troisième site de liaison du Na+ dans les transporteurs de glutamate plus évolués (cf. site Ct et Position of the Third Na+ Site in the Aspartate Transporter GltPh and the Human Glutamate Transporter, EAAT1 2012).
3. Dans les autres transporteurs, HP2 contribue aussi principalement aux sites de liaison du substrat comme dans vcINDY, vcCNT, SeCitS…
- Chez GltPh, HP2 n'a aucune interaction avec le domaine d'échafaudage, i.e. elle s'ouvre et se ferme sans changements structurels dans le domaine d'échafaudage.
- Dans d'autres transporteurs, ce n'est pas le cas, comme, par exemple, dans ChbC, où une partie du domaine d'échafaudage contribue au site de liaison (Crystal structure of a phosphorylation-coupled saccharide transporter 2011).
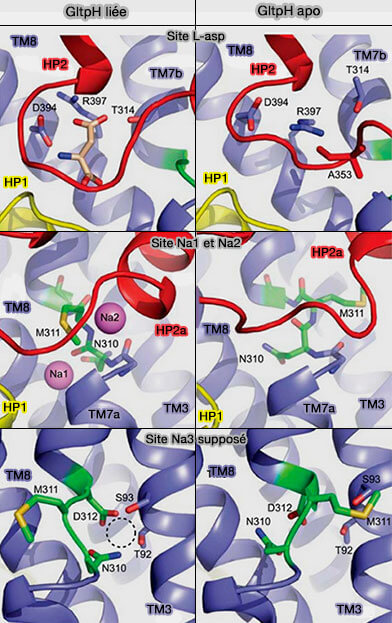
Site de liaison aux ions
(Figure : vetopsy.fr d'après Verdon et coll)
GltPh, vcINDY, vcCNT, SeCitS et les transporteurs d'acide biliaire sont tous couplés au gradient électrochimique (driving force) du sodium (Na+).
Les transporteurs de glutamate transportent, en général, une molécule de substrat avec trois ions Na+ et un H+. Après leur libération dans le cytoplasme, le contre-transport d'un ion K+ réinitialise le transporteur pour le cycle suivant. GltPh ne comporte pas de troisième site sodique, ni d'antiport.
Dans GltPh, la liaison coopérative des ions Na+ et L-asp est essentielle pour le transport étroitement couplé des solutés ((Binding thermodynamics of a glutamate transporter homologue 2013).
- GltPh est entièrement occlus en l'absence d'ions et de substrat (Coupled ion binding and structural transitions along the transport cycle of glutamate transporters 2014).
- Lorsque les ions Na+ sont liés seuls, sans substrat, la porte H2 est laissée ouverte.
- Le substrat seul ne peut se lier sans la coopération des ions Na+.
1. Les liaisons de L-asp et Na+ dans Na2 sont couplées car l'extrémité de HP2 contribue aux deux sites et est reconformée lors de la liaison.
- Met311 dans le motif NMD est le seul résidu qui est partagé entre le site Na1 et le substrat et les sites Na2 et subit également un changement conformationnel lors de la liaison du ligand.
- Met311 serait la clé du couplage allostérique entre les sites Na1, L-asp et Na2.
2. La liaison des ions couplés, notamment au site Na1, est suffisante pour déclencher l'isomérisation du domaine de transport de la conformation de l'apo à la conformation de type lié.
Cette hypothèse a été confirmée par la cristallisation de GltPh-R397A en présence de Na+ et en l'absence de L-asp qui révèle des conformations des domaines de transport globalement similaires à celles observées dans le transporteur entièrement lié : TM3 redressé, Met311 pointant vers les sites de liaison, hélice étendue dans HP2a et extrémité HP2 sur le site de liaison du substrat (Figure 6A-D).
(Figure : vetopsy.fr
d'après Verdon et coll)
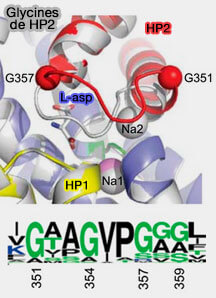
3. La structure de GltPh-R397A (affinité faible au substrat) liée au Na+ montre que la porte est ouverte.
- Cette ouverture est articulée autour de deux glycines (G351 et G357).
- Or la pointe de HP2 (résidus 351 à 359) comprend cinq glycines dans la séquence consensus de la famille du transporteur du glutamate, glycines qui permettraient la flexibilité de la pointe HP2.
- L'ouverture de l'extrémité de HP2 sur le site de liaison du sodium dans la conformation orientée vers l'extérieur pourrait donc inhiber l'absorption non couplée des ions Na+.

Les changements structurels dans le motif NMD et HP2 sont déclenchés lors de la liaison Na+ au site Na1.
- La perte d'interactions directes entre la pointe de HP2 et le reste du domaine de transport provoque l'ouverture de la porte.
- La liaison de L-asp et de Na+ au site Na2 est nécessaire pour fermer la porte HP2.
Un comportement conformationnel similaire a été observé pour les transporteurs avec le repliement LeuT : lorsqu'ils sont liés aux ions Na+, les sites de liaison au substrat sont ouverts à la solution extracellulaire et la fixation du substrat est nécessaire pour l'occlusion (
Comme dans les autres types de transporteurs, on trouve des variations, par exemple avec un seul Na+ lié (Structural basis of the alternating-access mechanism in a bile acid transporter 2014).
Remarque : dans le même article, en mettant GltpH en contact avec des ions Tl+ (ions thallium), on trouve, en plus de Na2', un site de liaison, appelé Ct, qui chevauche le site de liaison L-asp.
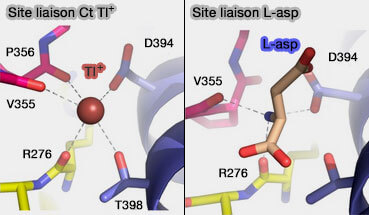
(Figure : vetopsy.fr d'après Verdon et coll)
Ct est formé par les chaînes latérales d'Asp394 et Thr398 hautement conservés dans TM8 et les atomes d'oxygène carbonyle de la chaîne principale de HP1 et HP2 : la liaison d'un cation au site Ct et la liaison du substrat s'excluent mutuellement.
- Ce site pourrait correspondre au site K+ dans les EAAT (transporteurs d'acides aminés excitateurs). En outre, dans un transporteur K+/dicarboxylate d'insecte, une mutation asparagine/aspartate à la position équivalente à Asp394 dans GltPh change la spécificité de substrat de transport au glutamate d'acide aminé, et conduit également à la dépendance au contre-transport de K+ (Novel Dicarboxylate Selectivity in an Insect Glutamate Transporter Homolog 2013).

Par conséquent, cet aspartate joue un rôle clé à la fois dans la liaison du groupe amine du substrat et dans le couplage au contre-transport K+.
Et HP1 ?
Certaines études ont suggéré que HP1 participe au déclenchement intracellulaire dans GltPh (The mechanism of substrate release by the aspartate transporter GltPh: insights from simulations 2010).
- HP1 et TM7a qui forment la surface cytoplasmique du domaine de transport semblent se déplacer légèrement vers TM8, avec la pointe de HP1 qui se détache de celle de HP2.
- Cependant, cette différence conformationnelle est trop petite pour être interprétée sans ambiguïté.
La translocation du domaine de transport chargé en substrat semble être l'étape la plus lente du cycle de transport (Transport domain unlocking sets the uptake rate of an aspartate transporter 2015).
- Cette caractéristique pourrait bien être particulière à GltPh, transporteur archaïque.
- En effet, dans les transporteurs de mammifères, le retour du domaine de transport sans substrat (avec K+) dans sa conformation ouverte vers l'extérieur est le plus lent (Substrate-modulated gating dynamics in a Na+-coupled neurotransmitter transporter homologue 2011).
Configurations intermédiaires
Les premiers mécanismes ont été décrits en 2009 : des configurations intermédiaires entre les deux décrites précédemment (vers l'extérieur et vers l'intérieur) sont évidemment envisageables.
1. Comme le domaine de transport est inséré dans la membrane et forme une sorte de cuvette remplie du milieu aqueux, extra- ou intracellulaire suivant la conformation du transporteur, et que la pointe de HP2 fait partie de cette interface, il est probable que des résidus polaires ou même des ions puissent intervenir dans des états intermédiaires (Structural Intermediates in a Model of the Substrate Translocation Path of the Bacterial Glutamate Transporter Homologue GltPh 2012 et Transient formation of water-conducting states in membrane transporters 2013).
2. Les structures cristallines révélées récemment de NapA, GltPh et SeCitS montrent que des chaînes hydrocarbonées de lipides et de détergents peuvent entrer dans l'interface entre les domaines du transporteur, facilitant peut-être leurs mouvements relatifs (Crystal structures reveal the molecular basis of ion translocation in sodium/proton antiporters 2016).
Conclusion générale sur les mécanismes des transporteurs
Le mécanisme de couplage des mouvements de déclenchement et les transitions structurelles globales semblent être différents dans les ascenseurs, les rocker-switch et les rocking-bundle.
- Dans les rocker-switch, comme dans GLUT5 ou LacY, l'occlusion des portes par la déformation des hélices (TM10b et TM1/TM4 respectivement) enclenche la translocation du substrat.
- Dans les ascenseurs, ce couplage pourrait être dû à l'encombrement stérique des domaines de transport lorsque les portes sont ouvertes : la translocation serait provoquée uniquement par l'énergie thermique.
Par contre, il semble que la liaison du substrat facilite les transitions globales entre les états.
Retour ves les co-transporteurs (transporteurs secondaires)
Biologie cellulaire et moléculaireConstituants de la celluleMatrice extracellulaireReproduction cellulaireTransport membranaireCanaux ioniquesTransporteursUniportsPompesCo-transporteursMécanismes des transporteursRocker-switchRocking-bundleElevatorTrafic vésiculaireMoteurs moléculairesVoies de signalisation


