Moteurs moléculaires : dynéines
Fonctionnement général
- Biologie cellulaire et moléculaire
- Constituants de la cellule
- Matrice extracellulaire
- Reproduction cellulaire
- Biochimie
- Transport membranaire
- Moteurs moléculaires
- Voies de signalisation

Les dynéines, qui font partie des moteurs moléculaires linéaires, doivent se lier à d'autres molécules pour pouvoir déplacer les cargos le long des microtubules.
Vue d'ensemble du fonctionnement des dynéines
Les dynéines utilisent d'autres molécules pour pouvoir déplacer le cargo le long des microtubules : on appelle ces complexes DDA ou D2DA :
- une ou deux dynéines,
- une dynactine,
- un adaptateur.
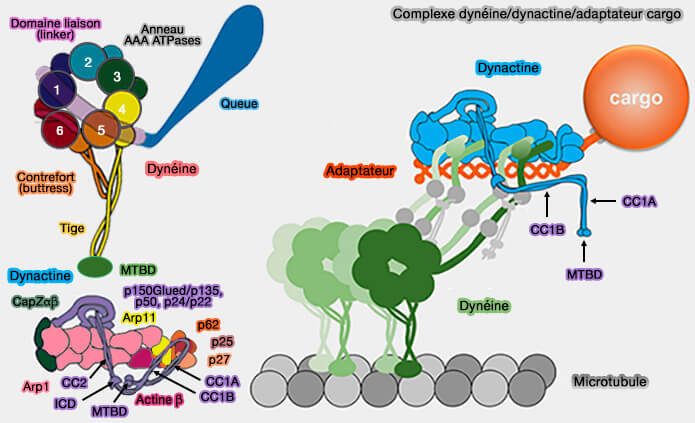
(Figure : vetopsy.fr d'après Xian et Qiu)
1. La dynactine, grosse molécule de 1 MDalton, se lie par sa sous-unité p150glued à la chaîne intermédiaire (IC) de la dynéine, mais cette liaison ne suffit pas.
L'élimination de la dynactine est sensiblement équivalent à celle de la dynéine.

La structure de la dynactine est étudiée dans un chapitre spécial.
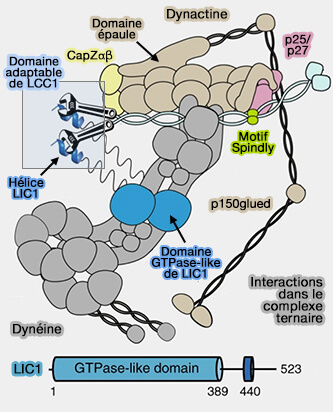
(Figure : vetopsy.fr d'après Lee et coll)
2. Un adaptateur protéique, contenant des domaines coiled-coil (superhélice), doit être pris en sandwich entre la dynactine et la dynéine pour les lier et provoquer le transport des cargos médié par un récepteur de cargo, i.e. le plus souvent une petite GTPase Rab sur un endosome (Activation of cytoplasmic dynein motility by dynactin-cargo adapter complexes 2014).

Sans adaptateur, la dynéine/dynactine ne forme pas un complexe stable malgré une liaison entre les deux molécules (
Un des premiers trouvés fut Bicaudal-D (BicD2), une protéine de la drosophile impliquée dans le transport des organites.
3. D'autres cofacteurs protéiques peuvent également être nécessaires pour le recrutement de la dynéine/dynactine dans le transport des cargos, comme LIS1 (LISsencephaly 1) et Nde1/Ndel1 (Nuclear Distribution Element 1/Nde-like1), appelées aussi Nude/Nudel (
Interactions générales
dans le complexe DDA
Trois points de contact majeurs entre la dynéine, la dynactine et les effecteurs permettent la formation des complexes ternaires appelés DDA (Dynein-Dynactin-cargo Adapter).
Chacune de ces interactions contribue en principe à l'affinité globale des complexes ternaires, ainsi qu'aux activités adaptatrices et régulatrices de chaque effecteur (A conserved interaction of the dynein light intermediate chain with dynein-dynactin effectors necessary for processivity 2018).
Interactions directes dynéine/dynactine
La dynéine et la dynactine interagissent par deux régions distinctes.
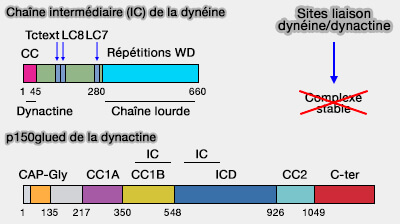
(Figure : vetopsy.fr d'après Siglin et coll)
1. La chaîne intermédiaire (IC) de la dynéine se lie directement à la sous-unité p150glued de la dynactine (Dynein and Dynactin Leverage Their Bivalent Character to Form a High-Affinity Interaction 2013 et (Autoregulatory Mechanism for Dynactin Control of Processive and Diffusive Dynein Transport 2014).
L'interaction serait due à une hélice H2 de IC qui se lierait au CC1B de p150glued (Interplay of Disorder and Sequence Specificity in the Formation of Stable Dynein-Dynactin Complexes 2020).
On peut interpréter ce mécanisme de deux manières différentes.
- Soit cette liaison renforce celles de l'adaptateur.
- Soit elle inhibe la dynéine et la liaison de adaptateur lève cette inhibition (Dynactin has two antagonistic regulatory domains and exerts opposing effects on dynein motility 2017).
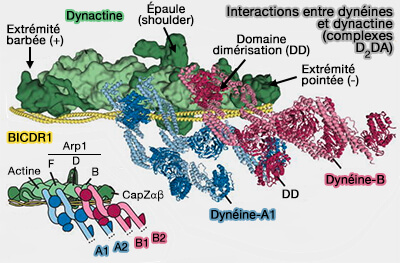
(Figure : vetopsy.fr d'après Urnavicius et coll)
2. Dans les complexes D2DA, et peut-être dans le DDA, ce serait le filament Arp1 plutôt que la sous-unité p150 qui interagit avec les queues des chaînes lourdes de dynéine (Cryo-electron tomography reveals that dynactin recruits a team of dyneins for processive motility 2018 et Cryo-EM shows how dynactin recruits two dyneins for faster movement 2018).
Interactions avec
les adaptateurs
1. Le long domaine coiled-coil (superhélice) des effecteurs s'intercale à l'interface entre la dynéine et la dynactine.
2. Les séquences N-terminales des divers effecteurs interagissent avec la chaîne légère intermédiaire (LIC) de la dynéine.
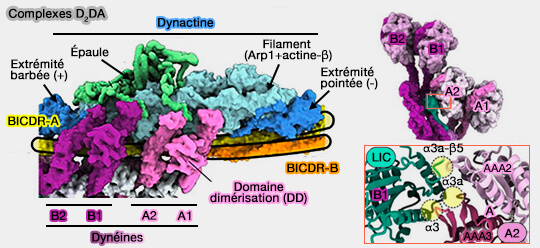
Complexes D2DA
Certains adaptateurs, comme BICDR1, sont présents en double dans les complexes D2DA, i.e. contenant deux dimères de dynéines, ce qui permet de préciser les interactions entre les dynéines (Structure of dynein-dynactin on microtubules shows tandem recruitment of cargo adaptors 2021).

Les mouvements des complexes D2DA sont étudiés avec les mouvements de la dynéine.
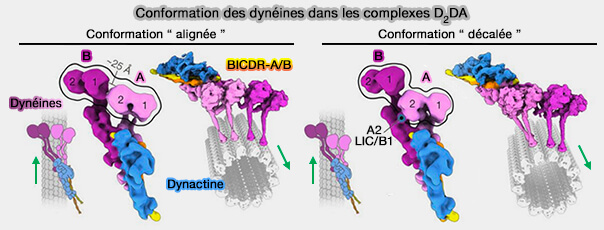
On trouve deux conformations principales des domaines moteurs dans les complexes D2DA.
1. Dans la première conformation, les domaines moteurs sont placés l'un à côté de l'autre, i.e. conformation " alignée " (aligned).
- Les quatre tiges sont parallèles les unes aux autres.
- Les domaines moteurs de la dynéine-A2 se trouvent à une distance de ∼25 Å de la dynéine-B1.
(Figure : vetopsy.fr d'après Chaaban et Carter)
2. Dans la deuxième conformation, la dynéine-A est derrière la dynéine-B, i.e. conformation " décalée " (stagerred).
- Les tiges de la dynéine-A1 se trouvent derrière celles de la dynéine-A2.
- Le domaine moteur de la dynéine-A2 est ancré sur la chaîne légère intermédiaire (LIC) de la dynéine-B1, ses AAA2 et AAA3 interagissent avec le domaine Ras-like de la LIC.
L'amarrage du moteur de la dynéine-B1 sur la LIC de la dynéine-A2 inhibe la plicature de son domaine de liaison, i.e. ne peut engager un powerstroke (
(Figure : vetopsy.fr d'après Chaaban et Carter)
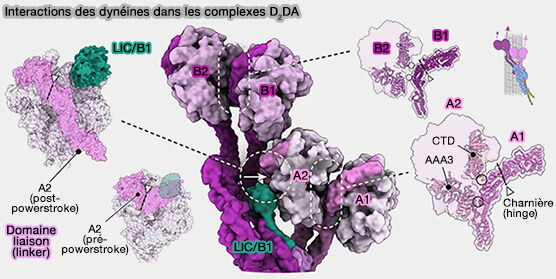
3. L'interface entre les domaines moteurs de la dynéine au sein de chaque dimère, i.e. dynéine-A1 à A2 et B1 à B2 est similaire dans les états alignés et décalés.
4. Le domaine de liaison du domaine moteur droit (A1/B1) se lie en deux points sur l'anneau gauche (A2/B2), à savoir AAA3 et le domaine C-terminal.
Les interactions sur les domaines de liaison de la dynéine-A1 et B1 se produisent du côté arrière de la charnière et ne devraient donc pas empêcher leurs domaines moteurs de se déplacer pendant une course d'amorçage (priming stroke).
5. Par contre, les monomères de gauche, dynéine-A2 et B2, lient leurs voisins par leurs anneaux. Cela empêche probablement leur domaine moteur de bouger.
Cela pourrait expliquer le pas hélicoïdal observé à droite de la trajectoire de la dynéine sur les microtubules (Cargo adaptors regulate stepping and force generation of mammalian dynein-dynactin 2019).
(Figure : vetopsy.fr d'après Chaaban et Carter)
Remarque : LIS1 augmente la formation des complexes D2DA dans le modèle " catalytic check valve " (clapet anti-retour catalytique).


