Moteurs moléculaires : dynéines
Activation
- Biologie cellulaire et moléculaire
- Constituants de la cellule
- Matrice extracellulaire
- Reproduction cellulaire
- Biochimie
- Transport membranaire
- Moteurs moléculaires
- Voies de signalisation

Les dynéines, qui font partie des moteurs moléculaires linéaires, doivent se lier à d'autres molécules pour pouvoir déplacer les cargos le long des microtubules.
Les dynéines utilisent d'autres molécules pour pouvoir déplacer le cargo le long des microtubules.
- la dynactine,
- des adaptateurs protéiques,
- d'autres cofacteurs protéiques comme de LIS1 (LISsencephaly 1) et Nde1/Ndel1 (Nuclear Distribution Element 1/Nde-like1), appelées aussi Nude/Nudel.
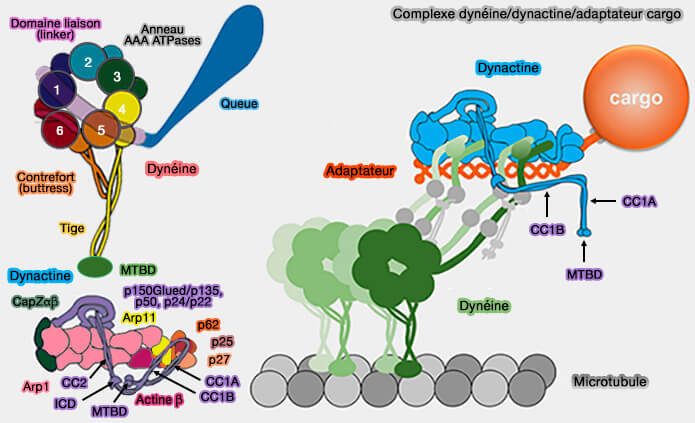
(Figure : vetopsy.fr d'après Xian et Qiu)
Formes de dynéines
La dynéine isolée se présente sous deux formes (Cryo-EM Reveals How Human Cytoplasmic Dynein Is Auto-inhibited and Activated 2017 et Structure and Mechanics of Dynein Motors 2021) :
- la particule phi, autoinhibée,
- la dynéine " ouverte ".
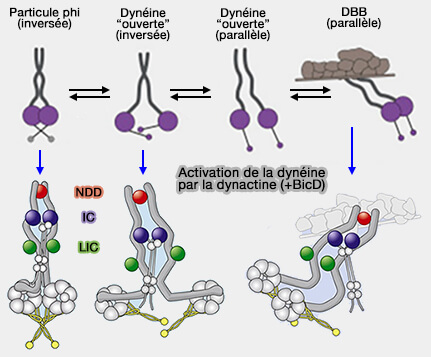
(Figure : vetopsy.fr d'après Zhang et coll)
1. La particule phi, i. qui ressemble à la lettre grecque φ, est verrouillée par l'auto-dimérisation des domaines moteurs qui interagissent par leurs domaines de liaison et les domaines de la tige ainsi qu'un contact entre la chaîne lourde et la queue.
Elle ne peut se lier :
- ni aux microtubules (ou très faiblement),
- ni à la dynactine et aux adaptateurs.
2. La dynéine " ouverte " se caractérise par des domaines moteurs séparés et assez flexibles, sous deux formes, i.e. inversée, le domaines moteurs pointent l'un vers l'autre, la plus fréquente, et parallèles.
- Dans la forme inversée, le domaine moteur libre n'est pas dans la bonne orientation pour se lier microtubules.
- La queue serait susceptible de déterminer la préférence de la dynéine ouverte pour la forme inversée.
Activation des dynéines
1. La dynactine et BICD2N, mais aussi les autres adaptateurs, peuvent activer la dynéine en faisant prendre aux moteurs de dynéine une forme parallèle pour s'accrocher aux microtubules (Structural organization of the dynein-dynactin complex bound to microtubules 2015).
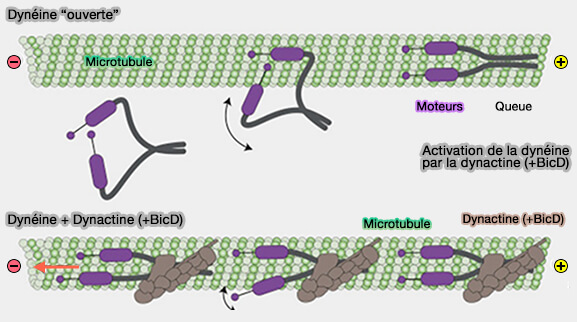
(Figure : vetopsy.fr d'après Zhang et coll)
La liaison de la dynactine :
- pré-aligne intrinsèquement la dynéine dans une conformation prête à se lier aux microtubules,
- limite également l'amplitude de mouvement des domaines moteurs individuels, i.e. minimise l'exigence de recherche d'un domaine de microtubule pour l'avancée pas à pas (
cycle mécanochimique de la dynéine).
La liaison de la dynactine induit une torsion du corps rigide des HC (
Toutefois, l'activation par l'adaptateur pourrait permette l'attachement des MTBD (Microtubule Binding Domain) de la dynactine sur les microtubules (Activation of cytoplasmic dynein motility by dynactin-cargo adapter complexes 2014).
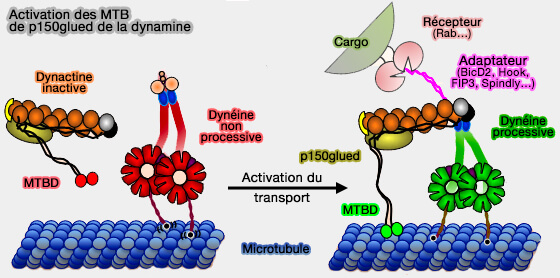
(Figure : vetopsy.fr d'après McKenney et coll)
2. LIS1 pourrait augmenter l'affinité de liaison des microtubules pour la dynéine seule, puisque les mutants à conformation " ouverte " présentent un taux d'association de microtubules plus élevé que la dynéine de type sauvage (
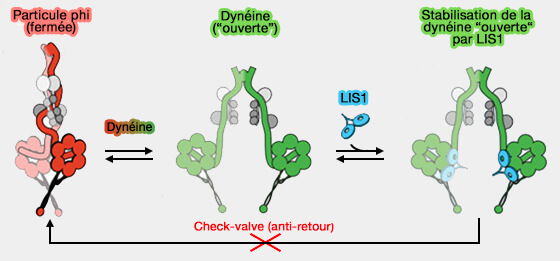
(Figure : vetopsy.fr d'après Markus et coll)


