Domaines protéiques
Domaines protéiques à doigt de zinc
Domaine ZZ

Les domaines ZZ sont des domaines hautement conservés et retrouvés dans de nombreuses protéines.
Ces domaines ont d'abord été découverts :
- dans la dystophine/utrophine (ZZ domain is essentially required for the physiological binding of dystrophin and utrophin to β-dystroglycan 2004 et ZZ domain of dystrophin and utrophin: topology and mapping of a β-dystroglycan interaction site 2007 et The ZZ Domain of Dystrophin in DMD : Making Sense of Missense Mutations 2015),
- dans le co-activateur transcriptionel CBP [CREB (CAMP-Response-Element-Binding protein)-Binding Protein]/P300 (ZZ Domain of CBP: an Unusual Zinc Finger Fold in a Protein Interaction Module 2004).
Structure du domaine ZZ
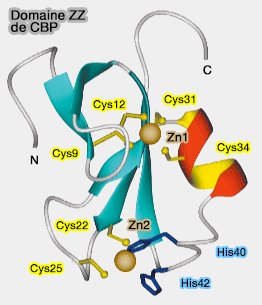
(Figure : vetopsy.fr d'après Legge)
1. Les domaines ZZ sont des domaines à deux motifs à doigt de zinc semblables aux domaines RING, PHD ou FYVE. Il comporte classiquement :
- 2 feuillets β (β sheet) antiparallèles à double brin,
- 7 cystéines et 1 histidine en général qui chélatent les deux ions zinc,
- une hélice α C-terminale.
2. Toutefois, dans la dystophine/utrophine des mammifères, le premier site contient une histidine, et le deuxième, moins conservé que le premier, a perdu deux cystéines en les remplaçant par une histidine et un acide aspartique.
Ce domaine ZZ fait partie d'un domaine riche en cystéine (CR), avec un domaine WW et deux mains EF, qui se lie au β-dystroglycane (
Fonctions du domaine ZZ
Les domaines ZZ sont impliqués dans les interactions protéine/protéine comme :
- les facteurs de transcription P300 et CBP,
- la dystophine/utrophine,
- les E3 ubiquitine ligases qui se lient à l'ARN comme MEX (The RNA-binding E3 ubiquitin ligase MEX-3C links ubiquitination with MHC-I mRNA degradation 2012 et A non-proteolytic role for ubiquitin in deadenylation of MHC-I mRNA by the RNA-binding E3-ligase MEX-3C 2015) et MIB2 (The E3 Ubiquitin Ligase Mind Bomb-2 (MIB2) Protein Controls B-cell CLL/Lymphoma 10 (BCL10)-dependent NF-κB Activation- 2011).
Retour aux domaines protéiques
Biologie cellulaire et moléculaireConstituants de la celluleMatrice extracellulaireReproduction cellulaireBiochimieChimie organiqueBioénergétiqueProtidesAcides aminésProtéinesDomaines protéiquesModifications post-traductionnelles des protéinesDégradations des protéinesUbiquitinationGlucidesLipidesEnzymesCoenzymesVitaminesHormonesTransport membranaireMoteurs moléculairesVoies de signalisation


