Lipides
Acides gras
: catabolisme des acides gras
bêta-oxydation (β-oxydation ou FAO)
Les quatre étapes
de la dégradation des acides gras pairs
- Biochimie
- Chimie organique
- Bioénergétique
- Composition de la matière vivante
- Composés organiques
- Protides
- Acides nucléiques
- Glucides
- Lipides
- Vue d'ensemble des lipides
- acides gras (FA)
- Classification des lipides
- Cholestérol
- Glycérides
- Trafic non vésiculaire des lipides et LTP
- Digestion et absorption entérocytaire des lipides
- Lipoprotéines
- Gouttelettes lipidiques (LD)
- Coenzymes
- Hormones
- Composés inorganiques
- Composés organiques
- Transport membranaire
- Moteurs moléculaires
- Voies de signalisation

Lors de la bêta-oxydation (β-oxydation ou FAO, fatty Acid β-Oxydation), les acides gras pairs, sous-forme d'acyl-CoA, subissent un cycle de dégradation en quatre étapes qui élimine chaque fois un acétyl-CoA.
Ce cycle est répété autant de fois que nécessaire pour aboutir à :
- l'acétyl-CoA, dont le groupe acétyle entre dans le cycle de Krebs,
- NADH et du FADH2, coenzymes utilisées dans la chaîne de transport des électrons qui alimentent la chaîne respiratoire.
1ère étape : Déshydrogénation
L'acyl-CoA subit une déshydratation entre C2 et C3 (α, β-déshydrogénation), catalysé par des acyl-CoA déshydrogénases (ACAD, i.e. EC 1.3.8.7) ) qui sont des enzymes flavoprotéiques à FAD utilisant des métaux.
$\ce{R-CH2-CH2-CH2-CH2-C(=O)-S-CoA + FAD}$ $\rightarrow$ $\ce{R-CH2-CH2-CH=CH-C(=O)-S-CoA + FADH_2}$
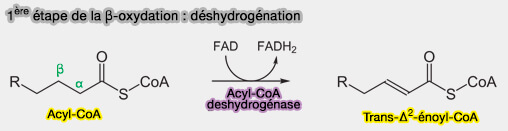
(Figure : vetopsy.fr)

Vous pouvez lire : Acyl-CoA dehydrogenases (2004) où les réactions biochimiques sont étudiées précisément
1. Les ACAD sont formés par 9 classes.
a. Cinq ACAD sont impliquées dans la β-oxydation des acides gras, selon la longueur de la chaîne acyle des acides gras :
- SCAD, i.e. Short Chain Acyl-CoA Dehydrogenase ou butyryl CoA déshydrogénase (EC 1.3.8.1) sur les acides gras (FA) de C4 à C6,
- MCAD, i.e. Medium Chaine (EC 1.3.8.7), sur les FA de C4 à C16,
- LCAD, i.e. Long Chain (EC 1.3.8.8), sur les FA de C10 à C18
- VLCAD1 et VLCAD2 (ACAD-9), i.e. Very Long Chain, i.e. EC 1.3.8.9 sur les FA supérieurs à partir C16.
Selon les auteurs, la longueur des FA peuvent un peu varier selon les enzymes.
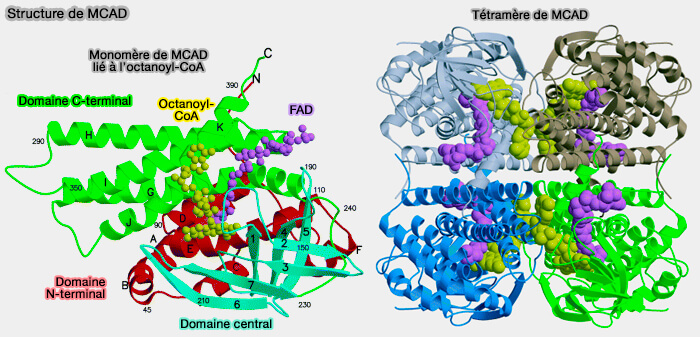
(Figure : vetopsy.fr d'après Kim et Miura)
b. Quatre autres sont impliquées dans le métabolisme des acides aminés à chaîne ramifiée :
- i3VD, i.e. isovaléryl-CoA déshydrogénase (EC 1.3.8.4) qui intervient dans le métabolisme de la leucine,
- i2VD, branched chain acyl-CoA déshydrogénase (EC 1.3.8.5), dans le métabolisme de l'isoleucine,
- iBD, isobutyryl-CoA déshydrogénase (EC 1.3.8.5), dans le métabolisme de la valine,
- GCDH, glutaryl-CoA déshydrogénase (EC 1.3.8.6) dans le métabolisme de la L-lysine, la L-hydroxylysine et le L-tryptophane.
(Figure : vetopsy.fr d'après Ghisla et Thorpe)
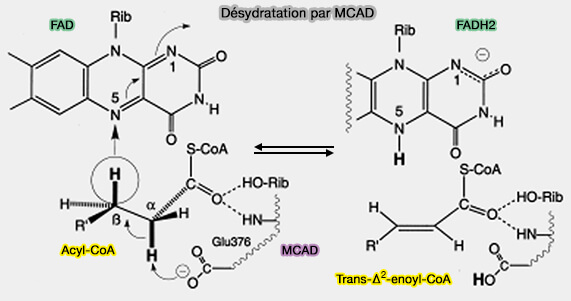
2. Le processus de déshydrogénation se distingue de la majorité des autres déshydrogénations car elle implique la rupture de deux liaisons C-H cinétiquement stables.
- Dans la plupart des autres cas, au moins un hydrogène est lié à un hétéroatome, autre que C ou H, et est cinétiquement labile.
- De plus, l'α,β-déshydrogénation se produit avec le transfert concomitant d'un hydrure équivalent à l'accepteur de flavine oxydé lié à l'enzyme.
(Figure : vetopsy.fr d'après Zhang et coll)
Les points saillants de cette réaction peuvent être résumés comme suit.
- la déshydrogénation se produit dans un mode trans.
- La fission des deux liaisons C-H se produit de manière concertée.
- L'hydrogène αC-H est extrait sous forme de H+ par la base du centre actif Glu376-COO-.
- L'hydrogène βC-H est transféré sous forme d'hydrure en position N(5) de la flavine.
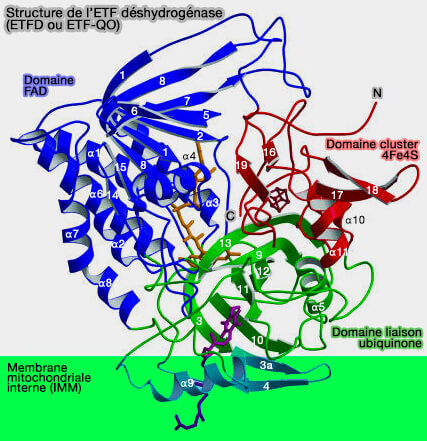
3. Deux équivalents réducteurs sont générés qui sont transférés (Structure of electron transfer flavoprotein-ubiquinone oxidoreductase and electron transfer to the mitochondrial ubiquinone pool 2006) :
- à la flavoprotéine de transfert d'électrons (ETF ou electron transfer flavoprotein complex, i.e. CETF), par la réoxydation de FADH2, qui à son tour transférera les hydrogènes,
- à la chaîne respiratoire, i.e. l'ubiquinone, via l'ETF déshydrogénase, i.e. ETFD ou ETF-QO (EC 1.5.5.1).
Le transfert d'électrons est le suivant :
$\ce{Acyl-CoA}$ $\rightarrow$ $\ce{Acyl-Co-déshydrogénase (ACAD)}$ $\rightarrow$ $\ce{ETF}$ $\rightarrow$ $\ce{ ETF-QO}$ $\rightarrow$ $\ce{ Ubiquinone}$ $\rightarrow$ $\ce{Complexe III}$

Au cours de cette déshydrogénation, l'acide insaturé formé est de structure trans, trans-Δ2-énoyl-CoA, alors que la plupart des acides gras naturels sont cis.
Étapes 2 à 4
Protéine trifonctionnelle mitochondriale (MTP ou TFP)
1. La protéine trifonctionnelle mitochondriale (MTP ou TFP) est un complexe mitochondrial dont l'unité biologique de la protéine est l'hétérotétramère α2β2 (Cryo-EM structure of human mitochondrial trifunctional protein 2018 et Crystal structure of human mitochondrial trifunctional protein, a fatty acid β-oxidation metabolon 2019).
a. Les deux sous-unités β forment un homodimère étroitement lié au centre.
HADHB catalyse l'étape 4, i.e activité 3-cétoacyl-CoA-thiolase (KT).
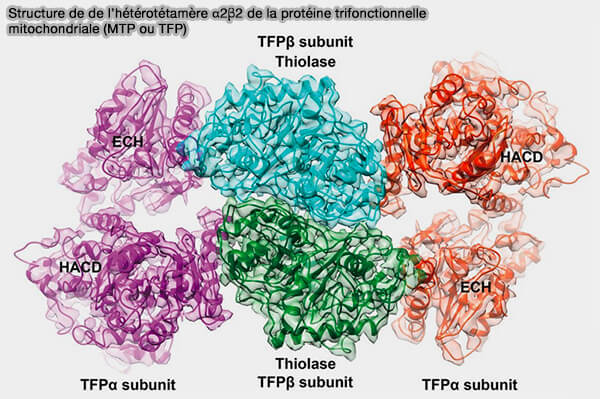
(Figure : vetopsy.fr d'après Liang et coll)
b. Les deux sous-unités α sont liées de chaque côté du dimère β2, créant un arc qui se lie sur son côté concave à la membrane interne mitochondriale.
HADHA catalyse les étapes 2 et 3, i.e. activités 2-énoyl-CoA hydratase (ECH) et 3-hydroxyacyl-CoA-déshydrogénase (HAD).
2. Les résidus catalytiques dans les trois sites actifs sont disposés de la même manière que ceux des enzymes monofonctionnelles solubles correspondantes. C'est ainsi que nous les décrivons ci-dessous.
Des mutations de deux gènes (HADHA et HADHB) provoquent le déficit en protéine trifonctionnelle mitochondriale (déficit en MTP ou MTPD), trouble d'oxydation des acides gras autosomique récessif, qui empêche l'organisme de convertir certaines graisses en énergie, en particulier pendant les périodes de jeûne.
2ème étape : Hydratation de la double liaison
L'hydratation de la double liaison du trans--Δ2-énoyl-CoA est assurée par une thiolenzyme, la 2-énoyl-CoA hydratase (ECH) ou crotonase, i.e. EC 4.2.1.17.
$\ce{R-CH2-CH2-CH=CH-C(=O)-S-CoA}$ $\leftrightharpoons$ $\ce{R-CH2-CH2-*CH(OH)-CH2-C(=O)-S-CoA}$
La fixation de l'eau donne naissance à un acide-alcool secondaire possédant un carbone asymétrique*.
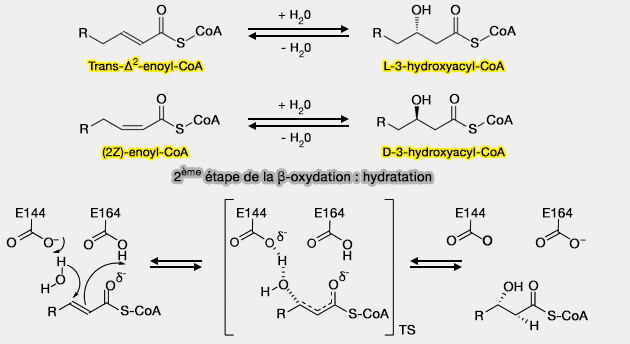
(Figure : vetopsy.fr)
Il semblerait que l'hydratation se déroule selon un mécanisme par étapes, impliquant un intermédiaire énolate (Theoretical Insight into the Catalytic Mechanism of Enoyl-CoA Hydratase 2017 et Structural Mechanism of Enoyl-CoA Hydratase: Three Atoms from a Single Water Are Added in either an E1cb Stepwise or Concerted Fashion 2002).
- Glu164 fonctionne comme l'unique base/acide pour la catalyse.
- Bien que Glu144 ne soit pas directement impliqué dans l'hydratation, il incite la molécule d'eau catalytique à localiser une orientation idéale pour attaquer la double liaison du substrat par l'interaction de liaison hydrogène.
- Les groupes NH du squelette d'Ala98 et de Gly141 forment un trou d'oxyanion avec l'oxygène carbonyle du substrat, qui jouent un rôle clé dans la liaison du substrat et dans la stabilisation des états de transition et des intermédiaires générés.
3ème étape : oxydation de la fonction alcool secondaire
La fonction alcool secondaire est oxydée en cétone par la 3-hydroxyacyl-CoA-déshydrogénase, (HAD), i.e. β-cétoréductase (KR) à NADH (EC 1.1.1.35).
$\ce{R-CH2-CH2-*CH(OH)-CH2-C(=O)-S-CoA + NAD+}$ $\leftrightharpoons$ $\ce{R-CH2-CH2-CO-CH2-CO-S-CoA + NADH + H+}$
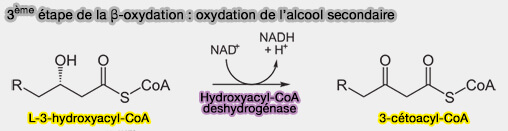
(Figure : vetopsy.fr)
4ème étape : scission (thiolyse) du dérivé β-cétonique
Le dérivé β-cétonique, le 3-cétoacyl-CoA, est clivé par thiolyse et non par hydrolyse, réaction nécessitant une nouvelle molécule de CoA et catalysée par une thiolase, la β-cétothiolase, i.e. thiolase I ou 3-cétoacyl-CoA thiolase (KT), ici, HADHB (EC 2.3.1.16), qui est active sur les longues chaînes.
$\ce{R-CH2-CH2-CO-CH2-CO-S-CoA}$ $\leftrightharpoons$ $\ce{R-CH2-CH2-CO-S-CoA + CH3-CO-S-CoA}$
1. Cette scission détache du 3-cétoacyl-CoA, un acétyl-CoA, produisant un acyl-CoA à 2 carbones de moins.
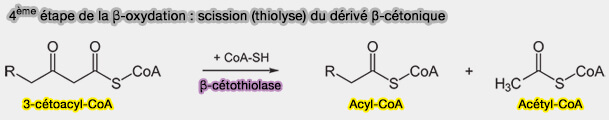
(Figure : vetopsy.fr)
2. Cet acyl-CoA raccourci pourra subir un nouveau cycle de β-oxydation qui conduira donc, à chaque cycle, à une molécule de FADH2, une de NADH et une d'acétyl-CoA
À titre d'exemple, l'acide palmitique (C16:0), une fois activé en palmitoyl-CoA, subira 7 cycles de β-oxydation pour générer 8 molécules d’acétyl-CoA, 7 FADH2 et 7 NADH.
Remarque : la dernière scission pourrait aussi faire intervenir l'acétyl-CoA acyltransférase 2 (ACAA2), i.e. EC 2.3.1.9.
$\ce{CH3-CH2-CO-S-CoA + CoA}$ $\leftrightharpoons$ $\ce{2 CH2-CO-S-CoA}$
Le reste acétique pourra alors rejoindre le cycle de Krebs.
Bilan de la β-oxydation
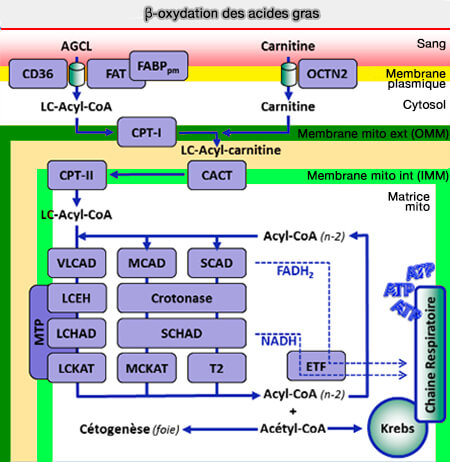
(Figure : vetopsy.fr d'après has-santé.fr)
1. La β-oxydation s'effectue dans les mitochondries qui renferment toutes les enzymes des phosphorylations oxydatives, i.e. l'énergie libérée permettra la synthèse d'ATP.

Chaque cycle de β-oxydation fournit donc 5 ATP et une molécule d'acétyl-CoA.
2. L'oxydation complète de l'acétyl-CoA par le cycle de Krebs fournit 12 ATP.
3. Par exemple pour l'acide palmitique (C16:0) qui subit 7 clivages :
- 3 ATP (NADH) x 7 = 21,
- 2 ATP (FADH) x 7 = 14,
- 12 ATP (acétyl-CoA) x 8 = 96.
a. Il faut enlever 2 ATP pour l'activation de l'acyl-CoA, i.e. 129 ATP en tout.
b. Pour tout acyl avec 2 carbones en plus, on doit rajouter 17 ATP.
Remarque : certains, comme dans Wikipedia, minimise le nombre d'ATP produits.
Autres β-oxydations mitochondriales et β-oxydation peroxisomale
BiochimieChimie organiqueBioénergétiqueProtidesGlucidesLipidesacides gras (FA)Synthèse des acides grasβ-oxydationCorps cétoniquesOxylipinesLipides vraisLipides vrais simplesLipides vrais complexesLipoïdesCholestérolGlycéridesPhospholipidesGlycérophospholipidesSphingophospholipidesTrafic non vésiculaire et LTPDigestion et absorption entérocytaire des lipidesLipoprotéinesApolipoprotéinesGouttelettes lipidiques (LD)EnzymesCoenzymesVitaminesHormonesComposés inorganiquesTransport membranaireMoteurs moléculairesVoies de signalisation


