Isomérie : stéréoisomérie de conformation
Projection de Newman et alcanes
- Biologie cellulaire et moléculaire
- Biochimie

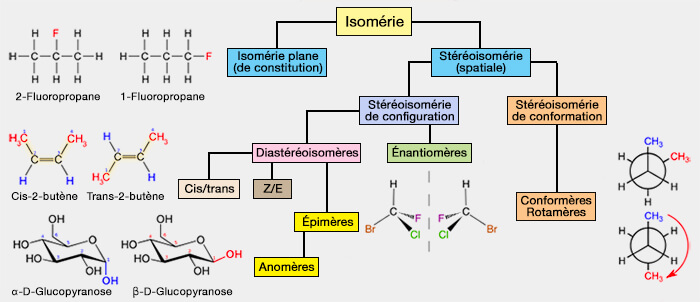
Les stéréoisomères sont des isomères (même formule brute) à même formule développée, mais dont la géométrie spatiale est différente.
Les stéréoisomères se différencient soit par leur représentation dans l’espace, i.e. stéréoisomérie, qui peut être une :
-
- une stéréoisomérie de conformation ou conformérie par simple rotation autour d'un axe d'une liaison simple (en général $\ce{C-C}$),
- une stéréoisomèrie de configuration qui nécessite une rupture de liaison.
(Figure : vetopsy.fr)
Ces molécules peuvent avoir des propriétés physiques, chimiques et biologiques très différentes.
Nous donnerons chaque fois un ou plusieurs exemples, sachant qu'il en existe des infinités.
Vue d'ensemble des stéréoisoméries de conformation

Les stéréoisomères de conformation sont des stéréisomères qui ne se différencient que par la rotation autour d'une liaison simple (liaison σ), c'est-à-dire sans rupture de liaisons.
La liaison σ possède une symétrie axiale dont l’axe est un axe de rotation. La liaison σ permet donc une libre rotation autour de son axe. Ceci est vrai pour les liaisons σ : $\ce{C-C, C-O, C-N}$…
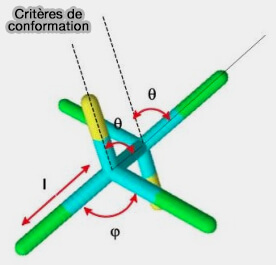
La conformation d'une molécule est la forme qu'elle prend dans l'espace selon certains critères :
- les longueurs des liaisons l,
- les angles de flexion φ,
- les angles dièdres de rotation (θ) autour des liaisons simples.
(Figure : vetopsy.fr)
1. La conformation d’une molécule (versus configuration) représente donc les différentes dispositions des groupements qui la composent, par suite de la libre rotation autour d’une liaison $\ce{C–C}$ (
On peut trouver plusieurs définitions pour ces molécules : conformères ou rotamères.
- Soit, les conformères ou rotamères représentent les différentes conformations d’une molécule suite de cette rotation.
- Soit, souvent, ce terme définit le stéréoisomère à la conformation la plus stable, c'est-à-dire celui dont l'énergie potentielle est la plus basse.
2. Contrairement à la stéréoisomérie de configuration, le passage d’une conformation à une autre ne nécessite pas de rupture de liaison.
- Cette isomérie ne consomme qu'une faible quantité énergie, correspondant à celle causée par l’agitation thermique à température normale (énergie cinétique due à une agitation désordonnée des molécules et des atomes).
- En théorie, les molécules peuvent s'isomériser continuellement et il est en général impossible de les isoler (sauf à de très basses températures).
3. Toutefois, une conformation est souvent plus stable qu'une autre énergétiquement, et dépendent de contraintes (cf. plus bas), qui peuvent être telles que la rotation est restreinte.

Certains stéréoisomères, appellés atropisomères (ou atropoisomères) - du grec " a ", privatif, et " tropos ", tourner -, sont des isomères dans lesquelles les différences d'énergie créent un obstacle à la rotation suffisamment élevé pour permettre leur isolement.
Le passage de l'un à l'autre rotamère est possible suivant le milieu ou un type de réaction chimique.
Projection de Newman
Pour représenter ces molécules, on peut utiliser la forme développée en 3D ou la forme en chevalet, appelée encore appelée cavalière (les différentes représentations des molécules dans l'espace).
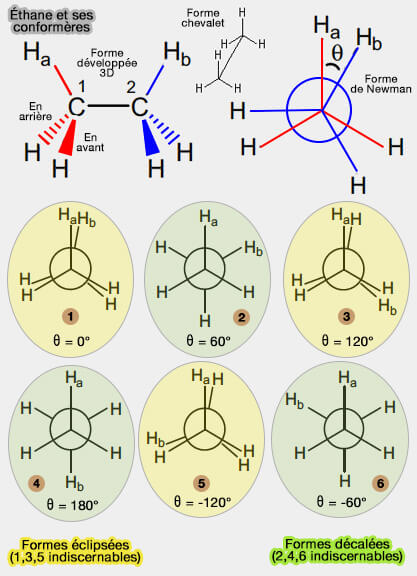
Mais, la meilleure façon est de se servir de la projection de Newmann, du nom du scientifique américain Melvin Spencer Newman (1908-1993) dans laquelle on regarde la molécule suivant son axe de rotation.

Une excellente vidéo permet de bien visualiser les projections : 
Éthane
Dans la figure de l'éthane ci-contre, on laisse C1 fixe et on fait tourner C2 de 360° autour de l'axe C1-C2.
(Figure : vetopsy.fr)
On passe par 6 configurations achirales, i.e. qui possèdent un axe de symétrie, en tournant chaque fois de 60°.
On les représente souvent sur un diagramme en prenant en abscisse l'angle du dièdre formé par les carbones et en ordonnée l'énergie potentielle.
1. Les conformations 1, 3 et 5 sont dites éclipsées, i.e. les éléments sont placés les uns derrière les autres (rotation à 0° - syn -) : pour plus de commodité sur les représentations, on déplace légèrement les atomes, sinon on ne les verrait pas du tout (éclipse).
2. Les conformations 2, 4 et 6 sont dites décalées, ou gauches, ce qui n'a rien à voir avec la droite ou la gauche, mais qui vient du verbe gauchir, i.e. tordre, ce qui veut dire que les atomes ne sont pas dans un même plan, lorsque les éléments sont en rotation de 60° l'un par rapport à l'autre.
Les trois formes éclipsées, comme les trois formes décalées, sont indiscernables, donc il n'existe seulement que deux stéréoisomères de l'éthane.
La conformation décalée est beaucoup plus stable que l'éclipsée, i.e. les électrons de liaison sont décalés dans 99% des cas.
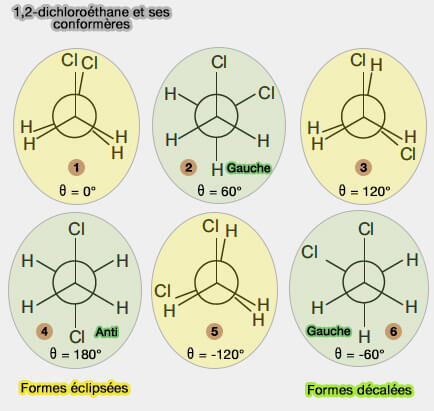
1-2-dichloréthane
Par contre lorsque les atomes sont différents, par exemple pour le 1-2-dichloréthane (H et Cl), on retrouve plusieurs stéréoisomères différents.
1. On retrouve les formes décalées :
- deux formes gauche (les $\ce{Cl}$ sont à 60°)
- une forme anti, forme décalée spéciale, dans laquelle si les $\ce{Cl}$ sont à 180° l'un par rapport à l'autre.
(Figure : vetopsy.fr)
2. Les formes éclipsées peuvent aussi être appelée pseudo-éclipsées. Pour préciser, don parle
- deux éclipsés $\ce{H-H}$ ,
- un éclipsé $\ce{Cl-Cl}$.
Les énergies sont différentes selon les conformères.
Composés
cycliques
Dans les composés cycliques, la fermeture de la chaîne sur elle-même ne permet pas de maintenir l’angle à la valeur optimale de 109° 28’’ pour le carbone tétrahédrique (
Un atome C est tertiaire s’il est relié à 3 atomes de carbone C (secondaire pour 2 liaisons et primaire pour 1). Il possède 4 électrons externes et donc formera 4 liaisons, i.e. il est dit tétrahédrique ou tétragonal pour une liaison simple, trigonal pour une liaison double, diagonal pour une liaison triple.
On parle de tension de cycles (ring strain) qui est une combinaison entre :
- la contrainte d'angle (ou contrainte de Baeyer, du nom du chimiste allemand Adolf von Baeyer - 1835-1917 -, prix Nobel en 1905), i.e. recouvrement optimal des orbitales atomiques à 109° 28’’ ;
- la contrainte de torsion (ou tension de Pitzer, du nom du scientifique américain Kenneth Sanborn Pitzer - 1914-1997 -), i.e. contrainte lorsque des atomes séparés par trois liaisons sont placés dans une conformation éclipsée au lieu de la conformation décalée plus stable ;
- la tension transannulaire (ou contrainte de van der Waals, du nom du scientifique néeanlandais Johannes Diderik van der Waals - 1837-1923 -), i.e. contrainte résultant de la répulsion de van der Waals lorsque deux substituants dans une molécule se rapprochent l'un de l'autre d'une distance inférieure à la somme de leurs rayons de van der Waals : cette contrainte est lié à l'encombrement stérique (disposition et le volume d'une partie d'une molécule par rapport à une autre partie).

Par contre, ces composés cycliques peuvent exister sous différents conformères pour les cycles à 5 carbones et plus.
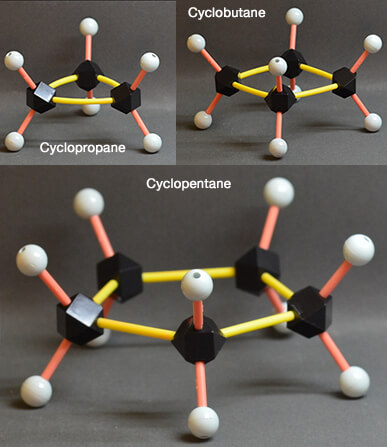
(Figure : vetopsy.fr)
1. Les cycles à 3 carbones et à 4 carbones se présentent sous une seule conformation par les fortes contraintes angulaires et stériques :
- Le cyclopropane ($\ce{C3H6}$) est très instable (triangle à angle de 60° à comparer 109° classique entre les carbones).
- Le cyclobutane ($\ce{C4H8}$) est sous forme plissée (les 4 carbones ne sont pas dans le même plan).
2. Les cycles à 5 carbones (cyclopentane : $\ce{C5H10)}$ ne peuvent que se distordent légèrement.
- Ils prennent une forme " enveloppe " (ou demi-chaise) par diminution des contraintes stériques imposée par la position éclipsée de tous les composants du cycle et les angles de 108° plus proches de l'angle canonique entre les carbones.
- Les 4 carbones sont dans même plan et le cinquième au dehors, les hydrogènes sont orientés à l'extérieur du cycle.
3. Pour les cycles de plus grande taille, les déformations sont possibles pour minimiser les contraintes entre chacun des carbones.
Dans le cas du cyclohexane ($\ce{C6H12}$), dont la forme devrait être hexagonale, trois configurations sont remarquables : (
- deux formes chaises - chaise et chaise inverse - (tous les substituants sont décalés), les plus stables, qui sont des conformations dites rigides ; toutes les autres sont dites flexibles.
- la forme bateau dans laquelle se produit un basculement d'une des branches du cycle qui permet le passage d'une chaise à l'autre (
basculements entre les conformations) : ce composant est moins stable car 8 hydrogènes sont en conformation éclipsée à la base du bateau et les deux hydrogènes internes de la poupe et la proue se gênent stériquement (tension transannulaire).
- des conformations intermédiaires sont représentées par des demi-chaises et bateaux-croisés qui diminuent cette tension tranannulaire (
déssiner un cyclohexane).
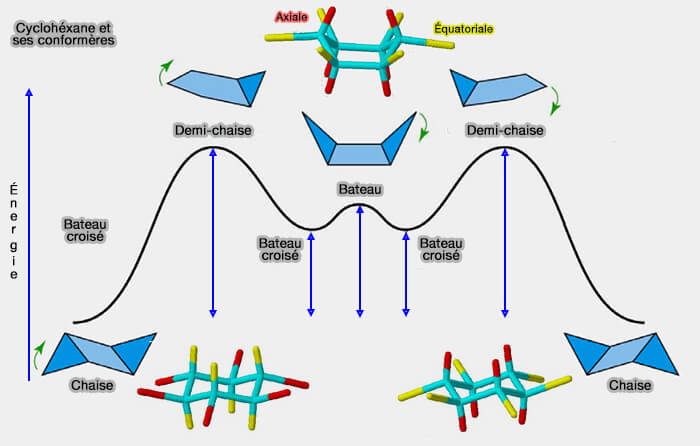
(Figure : vetopsy.fr)
Stéréoisomérie de configuration
Biologie cellulaire et moléculaireConstituants de la celluleMatrice extracellulaireReproduction cellulaireBiochimieChimie organiqueBioénergétiqueProtidesAcides aminésProtéinesAcides nucléiquesGlucidesLipidesEnzymesCoenzymesVitaminesHormonesComposés inorganiquesTransport membranaireMoteurs moléculairesVoies de signalisation


