Constituants cellulaires : protéasome 26S
Assemblage du coeur catalytique
- Biologie cellulaire et moléculaire
- Constituants de la cellule
- Membrane plasmique
- Noyau
- Cytoplasme
- Hyaloplasme
- Cytosol
- Cytosquelette
- Proteasome
- Vue d'ensemble
- Structure générale du protéasome 26S
- Assemblage du protéasome 26S
- Fonctionnement du protéasome
- Morphoplasme : organites
- Hyaloplasme
- Matrice extracellulaire
- Reproduction cellulaire
- Biochimie
- Transport membranaire
- Moteurs moléculaires
- Voies de signalisation

Des protéines chaperons assemblent le protéasome 26S, mais n'ont aucune activité dans son fonctionnement.
On compte une dizaine de protéines chaperons (Molecular Architecture and Assembly of the Eukaryotic Proteasome 2013).
Les protéines chaperons (chaperons moléculaires) sont des molécules qui assistent d'autres protéines pour leur maturation en facilitant leur pliage ou leur dépliage, ou d'autres structures macromoléculaires pour leur assemblage ou leur démontage.
Cet assemblage s'effectue indépendamment pour le coeur catalytique et le complexe régulateur.
Assemblage du coeur catalytique
Dans la plupart des espèces, l'assemblage de coeur catalytique 20S se produit dans l'ordre suivant :
- formation de l'anneau des sous-unités α,
-
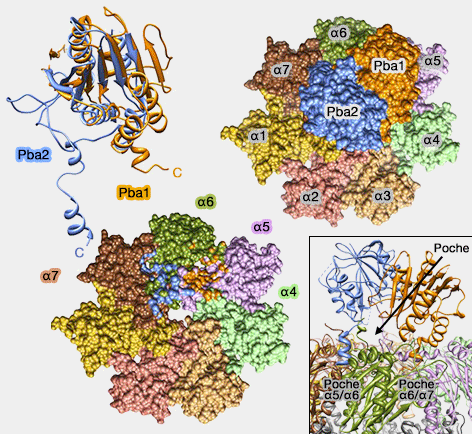
Pba1/2 et ses liaisons
(Figure : vetopsy.fr d'après Stadtmueller) - dimérisation pour former le coeur catalytique 20S,
- maturation finale grâce à un clivage des propeptides β.
Anneau α
Les dimères Pba1/Pba2, Pba3/Pba4 (Proteasome biogenesis-associated protein ou POC) chez la levure, appelées PAC1/4 (Proteasome Assembly Chaperone) chez l'Homme, sont essentielles à la formation de l'anneau α in vitro et in vivo (Assembly Mechanisms of Specialized Core Particles of the Proteasome 2014).
1. Pba1/Pba2 interagissent directement avec α4, α5, α6 et α7 pour favoriser l'assemblage dans une bonne position des sous-unités α (Structure of a Proteasome Pba1-Pba2 Complex Implications for proteasome assembly, activation and biological function 2012).
Pba1/Pba2 se lie par leur motif HbYX de leur extrémité C-terminale (comme les domaines AAA des Rpt) dans la poche α5/α6 et α6/α7 respectivement (cf. positionnement de l'anneau ATPase).
- Ces liaisons sont utilisées par 19S ou PA200/Blm10, ce qui prévient une liaison prématurée d'un complexe régulateur (Catalytic Mechanism and Assembly of the Proteasome 2009). Par contre, Pba1/Pba2 n'est pas un activateur protéasomal.
-
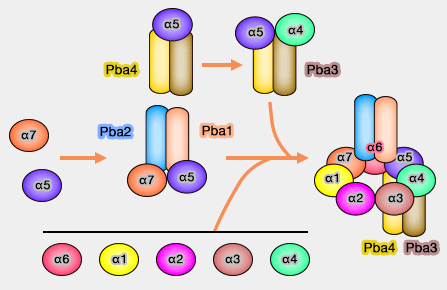
Assemblage simplifié (avec variantes) de l'anneau α
(Figure : vetopsy.fr)
Les extrémités N-terminales de α5, α6 et α7 sont séquestrées dans une poche de Pba1/Pba2, ce qui favorise la formation correcte du complexe en laissant les résidus N-terminaux de α2 et α3 plus enfouis.
On ne connait pas exactement la chronologie de l'incorporation des sous-unités.
- PAC1/PAC2 se lierait tout d'abord aux sous-unités α5 et α7, suivie par l'incorporation progressive de α6 et α1 (de chaque côté de α7), puis par α2 qui se lie à α1, α3 qui se lie α2, et α4 qui lie à la fois à α3 et α5 (A heterodimeric complex that promotes the assembly of mammalian 20S proteasomes 2005).
- Une autre variante, plus récente, est décrite ci-dessous.
2. Pba3/Pba4, qui se lie du côté opposé à Pba1/Pba2 (directement sur α5, mais aussi sur α4 et α6), permet l'association correcte d'α4 sur l'anneau (Pba3–Pba4 heterodimer acts as a molecular matchmaker in proteasome α-ring formation 2014).
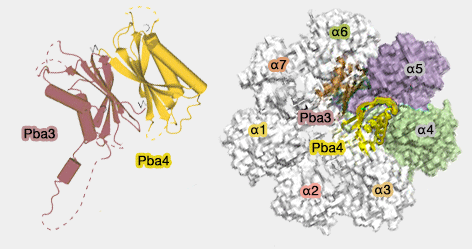
(Figure : vetopsy.fr d'après Takagi)
La perte de Pba3/Pba4 remplace α4 par α2.
Pba3/Pba4 se dissocie de l'assemblage lors de l'addition des sous-unités β (cf. plus bas), car c'est sur cette surface que vont se lier β4, β5, and β6 (Crystal structure of a chaperone complex that contributes to the assembly of yeast 20S proteasomes 2008).
Anneau β
Ump1 (Ubiquitin–mediated proteolysis ou POMP - hUmp1/UMP1 - chez l'Homme) joue un rôle dans l'assemblage du protéasome en coopération avec les sous-unités β (β-Subunit appendages promote 20S proteasome assembly by overcoming an Ump1-dependent checkpoint 2007).
1. β2 se lie avec Ump1 chez l'Homme et se fixe sur l'anneau α pour l'incorporation séquentielle des sous-unités β,
2. Puis, β3 est incorporé grâce au propeptide et à l'extrémité C-terminale de β2 et provoque la libération de PAC3/PAC4 de l'anneau α : se trouvant du même côté, il gênerait l'assemblage (Role of C-terminal Extensions of Subunits β2 and β7 in Assembly and Activity of Eukaryotic Proteasomes 2004).
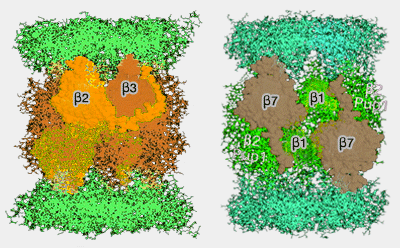
(Figure : vetopsy.fr d'après Ramos)
3. L'incorporation des autres sous-unités β4, β5, β6, β1 produit la formation d'un complexe précurseur, appelé " half-mer ", constitué de l'anneau α, β (sans β7), Ump1 et PAC1/PAC2 (15S intermédiaire).
À ce stade, les sous-unités β1, β2, β5, β6 possèdent toujours leur propeptides N-terminaux qui semblent jouer un rôle de chaperons intramoléculaires, surtout ceux de β2 et de β5 (Dissecting β-ring assembly pathway of the mammalian 20S proteasome 2008 et Structure, Assembly and Homeostatic Regulation of the 26S Proteasome 2010).
- Le propeptide de β5 est essentiel pour son incorporation dans l'anneau β de la levure, mais pas chez l'homme où il participe au recrutement de β6 : il joue aussi un rôle dans la dimérisation.
- Les propeptides de β1 et de β2 (ainsi que celui de β5) inhibe leur activité protéolytique qui détruirait l'assemblage à ce stade précoce.
- L'extrémité C-terminale de β2 qui s'enroule autour de β3 est essentiel pour la biogenèse du protéasome.
Chez la levure, c'est après la liaison de β2, β3 et β4 avec l'anneau α, le complexe s'appelant 13S, que Ump1 intervient.
Ump1, molécule non structurée, recouvre la cavité intérieure de complexe, le long de l'interface entre les sous-unités α et β (Biochemical and biophysical characterization of recombinant yeast proteasome maturation factor ump1 2013).
-
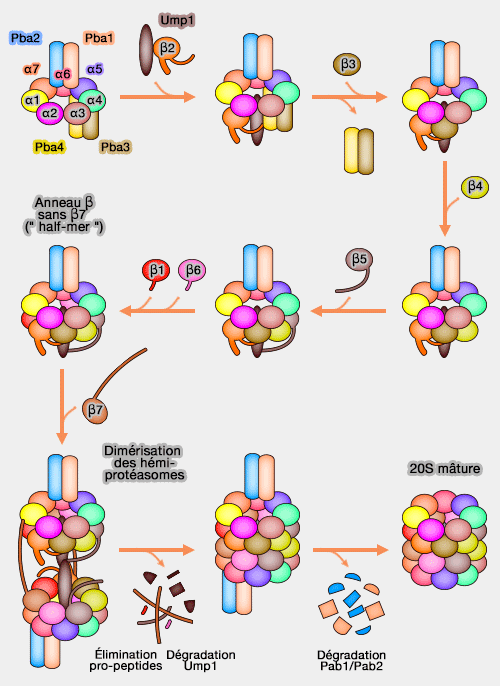
Assemblage du coeur catalytique du protéasome 26S
(Figure : vetopsy.fr) - Ump1, comme Pba1/Pba2 pour l'anneau α, prévient une dimérisation prématurée du complexe, mais est essentiel pour sa formation : sa perte provoque la formation d'assemblages incomplets.
- En outre, UMP1 se lie aux membranes et recrute les précurseurs au réticulum endoplasmique.
4. Puis, β7 est incorporé ce qui provoque :
- la dimérisation du complexe α et β grâce à :
- l'extrémité C-terminale de β7 qui se loge entre β1 et β2 de l'anneau opposé (The C-terminal Extension of the β7 Subunit and Activator Complexes Stabilize Nascent 20 S Proteasomes and Promote Their Maturation 2007) : elle joue aussi un rôle de stabilisation de la conformation active de β1 (cf. figure) ;
- le propeptide de β5 qui pourrait aligner et joindre les deux " half-mer " chez la levure. Ce propeptide est pauvrement conservé ultérieurement, ce qui est curieux vu son rôle par son association avec Ump1 (β-Subunit appendages promote 20S proteasome assembly by overcoming an Ump1-dependent checkpoint 2007 et Dissecting β-ring assembly pathway of the mammalian 20S proteasome 2008). Les propeptides de β6 et de β7 semblent aussi faciliter la dimérisation ;
- Le complexe anneau α, β, Ump1 et PAC1/PAC2 est appelé 16S intermédiaire (il y en a donc 2) ;
- l'élimination des propeptides des sous-unités β1, β2, β5, β6 et β7 : ces propeptides étaient essentiels pour l'intégration et la protection des sites catalytiques (pour β1, β2 et β7) ;
- la dégradation de Ump1 en premier, puis de PAC1/PAC2 qui pourront être dégradés par le protéasome grâce à la scission des propeptides et la libération des sites actifs (Thr1).
Chez la levure, un autre scénario pourrait conduire à ce que Pba1/Pba2 soit expulsé de l'anneau α par la restructuration de l'anneau β qui resserrerait l'anneau α. Pba1/Pba2 serait alors recyclé pour participer à un nouvel assemblage (Proteasome assembly from 15S precursors involves major conformational changes and recycling of the Pba1-Pba2 chaperone 2014).
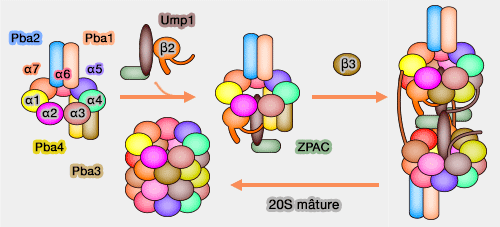
(Figure : vetopsy.fr)
Ce scénario de l'agrégation des sous-unités β peut être un peu différent dans les immunoprotéasomes et les thymoprotéasomes (Assembly Mechanisms of Specialized Core Particles of the Proteasome 2014).
Remarque : lors du développement embryonnaire, après la mi-blastulation (MBT : MidBlastula Transition), étape de la segmentation à partir de laquelle la transcription génique zygotique se met en marche, les protéines maternelles doivent être dégradées massivement pour laisser les protéines synthétisées par l'embryon faire leur office. L'assemblage des protéasomes est fortement activée par ZPAC (Zygote-specific CP assembly chaperone), qui se lie directement à Ump1 (Mouse zygote-specific proteasome assembly chaperone important for maternal-to-zygotic transition 2013 et The Ubiquitin-proteasome System in the Maternal-to-zygotic Transition 2013).
Assemblage du complexe régulateur 19S
Biologie cellulaire et moléculaireMembrane plasmiqueNoyauCytoplasmeRéticulum endoplasmiqueAppareil de GolgiMitochondriesEndosomesLysosomesPeroxysomesProtéasomesCytosquelettemicrofilaments d'actineFilaments intermédiairesMicrotubulesMatrice extracellulaireReproduction cellulaireBiochimieTransport membranaire Moteurs moléculairesVoies de signalisation


