Lipides
Acides gras
Oxylipines
lipoxygénases (LOX) : 5-LOX (ALOX5)
- Biochimie
- Chimie organique
- Bioénergétique
- Composition de la matière vivante
- Composés organiques
- Protides
- Acides nucléiques
- Glucides
- Lipides
- Vue d'ensemble des lipides
- acides gras (FA)
- Classification des lipides
- Cholestérol
- Glycérides
- Trafic non vésiculaire des lipides et LTP
- Digestion et absorption entérocytaire des lipides
- Lipoprotéines
- Gouttelettes lipidiques (LD)
- Coenzymes
- Hormones
- Composés inorganiques
- Composés organiques
- Transport membranaire
- Moteurs moléculaires
- Voies de signalisation

La 5-LOX (ALOX5), membre des lipoxygénases (LOX), est impliquée dans la synthèse des leucotriènes et des SPM (Specialized Pro-resolving Mediators, molécules intervenant dans les différentes phase de l'inflammation.
Structure de la 5-LOX
1. La 5-LOX (5-LO) est une dioxygénase contenant deux domaines (The structure of human 5-lipoxygenase 2011 et Structural and mechanistic insights into 5-lipoxygenase inhibition by natural products 2020) :

(Figure : vetopsy.fr d'après Häfner et coll)
a. Le petit domaine N-terminal régulateur C2-like, tonneau bêta de 120 résidus environ, qui se lient à divers composés dont le calcium et à la phosphatidylcholine dans les membranes.
Ce domaine n'est pas requis pour l'activité catalytique en elle-même, mais est essentiel :
- à la liaison et la régulation membranaire,
- à la translocation dépendante du calcium du cytosol ou du noyau (selon le type de cellule) vers l'enveloppe nucléaire.
b. Le domaine catalytique en hélice α qui contient le fer non hémique, coordonné par trois histidines conservées, le groupe carboxyle de l'extrémité C-terminale, une molécule d'eau et un dernier ligand variable, i.e. eau, histidine, asparagine ou sérine selon les LOX (The structural basis for specificity in lipoxygenase catalysis 2015).
Particularités et
mécanisme de la 5-LOX
La 5-LOX possède plusieurs propriétés uniques dans la famille des LOX.
Stimulation de l'activité
1. L'activité de la 5-LOX est stimulée par les diglycérides (DAG) qui se lient au domaine de type C2 de la 5-LOX (1-Oleoyl-2-acetylglycerol Stimulates 5-Lipoxygenase Activity via a Putative (Phospho)lipid Binding Site within the N-terminal C2-like Domain 2005).
2. Elle se lie à l'ATP et son activité dépend fortement du calcium ou de sa phosphorylation par des kinases (Beyond leukotriene formation—The noncanonical functions of 5-lipoxygenase 2019).
- Elle est stimulée par ERK sur Ser663 et MK-2/3 sur Ser271,
- Elle est inhibée par PKA sur Ser523 (Phosphorylation of 5-LOX: The Potential Set-point of Inflammation 2020).
Interaction avec COTL1
L'augmentation calcique ou la phosphorylation provoquerait son interaction dans le cytosol avec CLP (Coactosin-Like Protein ou COTL1) avec une Stoechiométrie 1/1, qui agit comme un chaperon et régule positivement sa production de leucotriène A4 ou LTA4 (Coactosin-like protein functions as a stabilizing chaperone for 5-lipoxygenase: role of tryptophan 102 2010).

(Figure : vetopsy.fr d'après Rakonjac)
1. COTL1 est composé d'un domaine ADF-H unique (Solution structure of coactosin reveals structural homology to ADF/cofilin family proteins 2004).
- COTL1 se compose de cinq feuillets β (β sheet) avec deux hélices de chaque côté.
- La boucle entre β3-β4 est flexible tandis que les autres régions seraient rigides (Studies on Coactosin-Like Protein Interaction with 5-Lipoxygenase 2009).
2. COTL1 peut se lier à :
- La 5-LOX par Lys131,
- l'actine F par Lys75 pour favoriser la dynamique du cytosquelette (The Role of Human Coactosin-Like Protein in Neurodegenerative Disorders 2017).
Il semblerait que les deux sites, proches l'un de l'autre, se chevauchent et empêchent la formation d'un complexe ternaire.

COTL1 est indispensable à la translocation nucléaire et à l'activité complète de 5-LOX (Roles of coactosin-like protein (CLP) and 5-lipoxygenase-activating protein (FLAP) in cellular leukotriene biosynthesis 2014).
Interaction avec FLAP
Le complexe 5-LOX/CLP migre alors vers la membrane nucléaire et 5-LOX interagit avec FLAP (Five‑Lipoxygenase Activating Protein), sa protéine activatrice, qui transfère l'acide arachidonique vers la 5-LOX pour la conversion en leucotriène A4 (LTA4).
1. FLAP (Five‑Lipoxygenase Activating Protein) est une protéine membranaire intégrale appartenant à la famille MAPEG ou Membrane-Associated Proteins in Eicosanoid and Glutathione metabolism avec :
- LTC4S (LTC4 synthase ou glutathion-S-transférase),
- MGST1/2/3 (MGST ou microsomal glutathione S-transférase),
- PTGES (Prostaglandin E synthase).
2. FLAP, sans aucune activité enzymatique contrairement aux autres MAPEG, est retrouvée sous forme trimérique dans la membrane nucléaire (Crystal Structure of Inhibitor-Bound Human 5-Lipoxygenase–Activating Protein 2007).
a. Chaque monomère est constitué par :
- une hélice luminale aL (résidus 3-8) N-terminale, reliée à l'hélice α1 par un seul résidu au niveau feuillet inférieur de la membrane,
- quatre hélices α transmembranaires, α1 (10-37), α2 (48-77), α3 (81-101) perpendiculaire à la membrane, et α4 (116-138) qui commence au milieu de la membrane et finit dans le lumen,
- une région C-terminale (<G140) désordonnée et conservée dans toutes les protéines FLAP.

(Figure : vetopsy.fr d'après Ferguson et coll)
b. On observe :
- deux boucles cytosoliques allongées, C1 (38-47) entre α1 et α2, et C2 (102-115) entre α3 et α4,
- une boucle luminale courte, i.e. L1 (78-80) entre α2 et α3.
c. Le trimère FLAP est perpendiculaire au plan membranaire et forme une poche cylindrique de liaison pour l'acide arachidonique qui permet son transfert vers le domaine catalytique 5-LOX.
Certaines molécules agissent comme des inhibiteurs de FLAP et les résidus impliqués sont explicités dans : What’s all the FLAP about?: 5-lipoxygenase-activating protein inhibitors for inflammatory diseases 2007 et l'article précédent.
3. FLAP Il peut favoriser le couplage fonctionnel de la phospholipase A2 (PLA2) à la 5-LOX pour extraire l’acide arachidonique de la membrane, PLA2 et 5-LOX dépendent toutes deux du Ca++.
Remarque : FLAP est également nécessaire à la synthèse du leucotriène C4 (LTC4), mais cette fois sans CLP (Roles of coactosin-like protein (CLP) and 5-lipoxygenase-activating protein (FLAP) in cellular leukotriene biosynthesis 2014).
Mécanisme de la 5-LOX
1. Dans les cellules au repos, la 5‑LOX soluble est présente selon le type de cellule, soit dans le cytosol, soit dans le noyau (Beyond leukotriene formation—The noncanonical functions of 5-lipoxygenase 2019).
Son activité est faible et contrairement aux prostaglandines, une augmentation de l’acide arachidonique libre ne suffit pas à elle seule à induire la synthèse des leucotriènes.
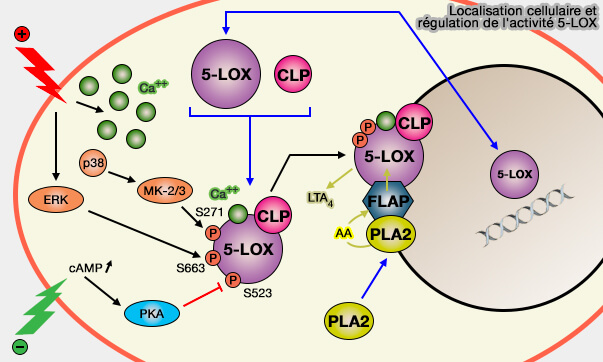
(Figure : vetopsy.fr)
2. En réponse à l'activation cellulaire, comme les ions Ca++ par exemple ou certains phosphorylations, 5-LOX co-migre avec la phospholipase A2 (PLA2) vers le membrane nucléaire de laquelle PLA2 libère l'acide arachidonique, 20:4(Δ5,8,11,14) ou 20:4(n-6), des phospholipides (PL) , en particulier de sn-2 des glycérophospholipides.
3. La localisation cellulaire du 5-LOX (nucléaire ou cytosolique) est régulée par des séquences qui contiennent en partie les sites de phosphorylation :
- au moins trois signaux de localisation nucléaire, ie NLS ou Nuclear Localization Sequence (Multiple Nuclear Localization Sequences Allow Modulation of 5-Lipoxygenase Nuclear Import 2004),
- une séquence d'exportation nucléaire, i.e. NES ou Nuclear Export Signal (Phosphorylation of Serine 271 on 5-Lipoxygenase and Its Role in Nuclear Export 2009).
Fonctions de la 5-LOX
Synthèse de leucotriènes et des SPM (Specialized Pro-resolving Mediators)
Son rôle canonique est la synthèse de leucotriènes et des SPM (Specialized Pro-resolving Mediators).
1. À partir de l'acide arachidonique, 20:4(Δ5,8,11,14) ou 20:4(n-6), elle forme 5(S)-HPETE ou 5-HPETE (acide 5-hydroperoxyeicostétraénoïque ou acide 5S,6E,8Z,11Z,14Z)-5-hydroperoxyicosa-6,8,11,14-tétraenoique) par l'incorporation d'une molécule d'oxygène en position C-5.
a. 5(S)‑HPETE, par la suite, peut être converti en leucotriène A4 (LTA4) qui peut produire :
- ses dérivés, LTB4, et les cystéinyl-leucotriènes, i.e. LTC4, LTD4 et LTE4 (
synthèse des leucotriènes),
- 5(S),6(S),15(S)-epoxytétraène à l'origine des lipoxines (LX).
b. 5(S)‑HPETE peut aussi produire 5S-HETE ou 5-HETE (acide 5(S)-hydroxyeicosatétraénoïque ou acide 5S,6E,8Z,11Z,14Z-5-hydroxyicosa-6,8,11,14-tétraénoïque), qui peut être métabolisé en :
- 5-oxo-ETE (acide 5-oxo-eicosatétraénoique), par oxydation catalysée par la 5-HEDH (5-hydroxyeicosanoïde déshydrogénase) microsomale dépendante de NADP, i.e. EC 1.1.1.232, qui peut rapidement être reconverti en 5(S)-HPETE
- 5(S),15(S)-diHETE (acide 5(S),15(S)-dihydroxyeicosatétraénoique),
- 5-oxo-15(S)-HETE (acide 5-oxo-15-hydroxyeicosatétraénoique).
c. Cette famille de métabolites entre dans la signalisation autocrine et paracrine de type hormonal pour augmenter les réponses inflammatoires et allergiques aiguës et feraient partie du système immunitaire inné.
2. À partir de 15(S)-HPETE ou 15-HPETE ou du 15(S)-HETE ou 15-HETE (acide15-hydroxyeicosatétraénoïque ou 5Z,8Z,11Z,13E,15S-15-Hydroxyicosa-5,8,11,13-tétraénoique) produit par 12S-LOX (ALOX12), 15-LOX-1 (ALOX15) et 15-LOX-2 (ALOX15B), elle conduit à la formation des lipoxines (LX), i.e. LXA4 et LXB4.
3. À partir de l'acide eicosapentaénoique (EPA), 20:5(Δ5,8,11,14,17) ou 20:5(n-3), elle produit :
- des métabolites à 5 doubles liaisons, i.e. 5-PEPE et ses dérivés, les leucotriènes 5, i.e. LTB5, LTC5, LTD5 et LTE5,
- des résolvines-E, i.e. RvE1 et RvE2.
4. À partir l'acide docosahexaénoique (DHA), 22:6(Δ4,7,10,13,16,19) ou 22:6(n-3), à l'origine des docosanoïdes, elle intervient dans la formation des résolvines-D (RvD1/6).
Fonctions non canoniques
La 5-LOX possède des fonctions supplémentaires (
- Elle régule les fonctions de p53 (tumor protein p53, ou Tp53) et de la β-caténine.
- Elle interagit avec Dicer pour moduler la formation des miARN (micro-ARN) sous certaines conditions physiologiques.
- Elle régule la promotion d'un état de cellules souches, i.e. stemness en anglais (‘Stemness’: Definitions, Criteria, and Standards 2014).
Retour vers les LOX
BiochimieChimie organiqueBioénergétiqueProtidesGlucidesLipidesacides gras (FA)Synthèse des acides grasβ-oxydationCorps cétoniquesOxylipinesLipides vraisLipides vrais simplesLipides vrais complexesLipoïdesCholestérolGlycéridesPhospholipidesGlycérophospholipidesSphingophospholipidesTrafic non vésiculaire et LTPDigestion et absorption entérocytaire des lipidesLipoprotéinesApolipoprotéinesGouttelettes lipidiques (LD)EnzymesCoenzymesVitaminesHormonesComposés inorganiquesTransport membranaireMoteurs moléculairesVoies de signalisation


