Enzymes
Groupe des hydrolases (EC 3)
GTPases : DSP (superfamille de la dynamine)
Dynamine : modèles de fission
- Biochimie
- Chimie organique
- Bioénergétique
- Composition de la matière vivante
- Composés organiques
- Protides
- Acides nucléiques
- Glucides
- Lipides
- Enzymes
- Classification des enzymes
- Oxydoréductases (EC 1)
- Transférases (EC 2)
- Hydrolases (EC 3)
- Lyases ou synthases (EC4)
- Isomérases (EC5)
- Ligases ou synthétases (EC 6)
- Classification des enzymes
- Coenzymes
- Vitamines
- Hormones
- Composés inorganiques
- Composés organiques
- Transport membranaire
- Moteurs moléculaires
- Voies de signalisation

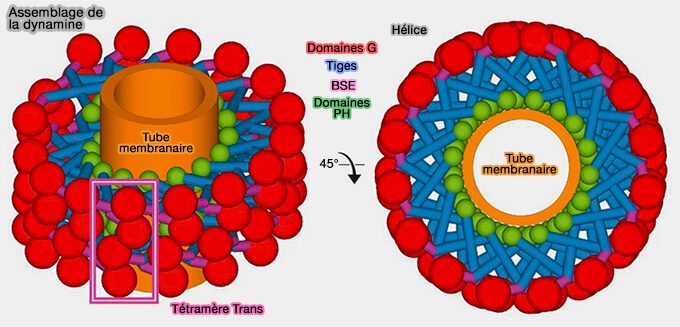
La dynamine fait partie de la superfamille de la dynamine (DSP : Dynamin Superfamily Proteins) qui comprend de nombreuses GTPases, de grande taille par rapport aux petites GTPases.
Les dynamines ont trois propriétés :
- 1. Elles s'auto-oligomérisent en hélices autour d'un tube membranaire (
oligomérisation de la dynamine).
- 2. Les changements conformationnels induits par les nucléotides conduisent à une constriction du polymère et donc de la membrane (
dynamine et GPT).
- 3. Les dynamines induisent la fission des cols membranaires par l'hydrolyse du GTP.
(Figure : vetopsy.fr d'après Antonny et coll)
Toutes ces observations ont conduit à deux modèles pour la fission catalysée par la dynamine.

Pour les discussions détaillées des modèles et sur les controverses, lire : Membrane fission by dynamin: what we know and what we need to know (2016) et Structural Insights into the Mechanism of Dynamin Superfamily Proteins (2019).
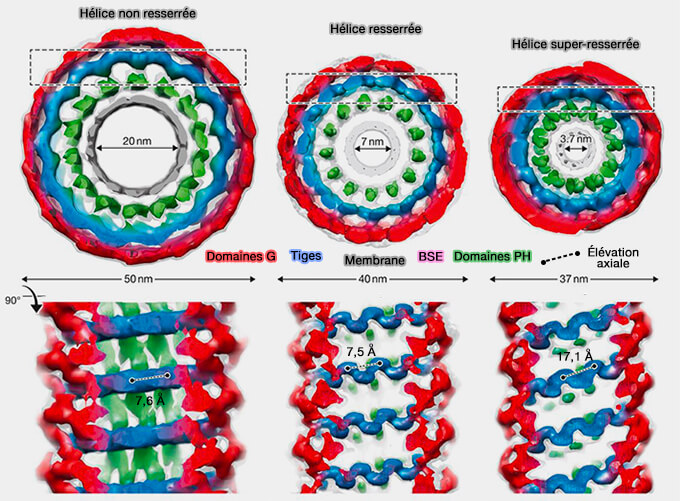
Figure : vetopsy.fr d'après Antonny et coll)
Modèle par démontage en deux étapes
Vue d'ensemble du modèle en deux étapes
Ce modèle concilie le fait que l'assemblage de la dynamine resserre la membrane et que la dynamine se démonte lors de l'hydrolyse du GTP, en suggérant toutefois que ces deux étapes soient distinctes dans le temps (GTPase Cycle of Dynamin Is Coupled to Membrane Squeeze and Release, Leading to Spontaneous Fission 2008 et A hemi-fission intermediate links two mechanistically distinct stages of membrane fission 2015).
Ainsi, bien que des échafaudages de dynamine soient nécessaires pour resserrer la membrane, ces mêmes échafaudages pourraient stabiliser le tubule sous-jacent et inhiber la fission.
1. La première étape serait l'assemblage de la dynamine, en présence de nucléotides, qui adopte un état super-resserré permettant la formation d'intermédiaires d'hémifission.
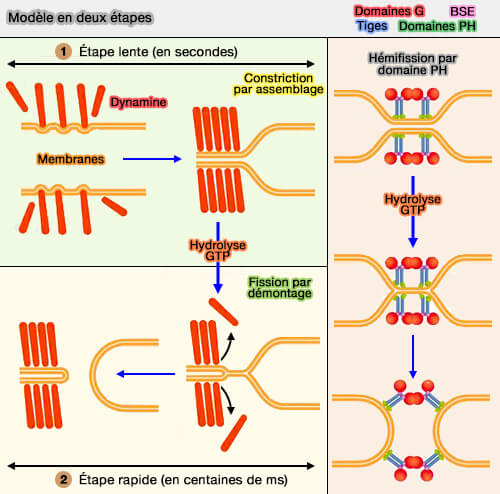
(Figure : vetopsy.fr d'après Antonny et coll)
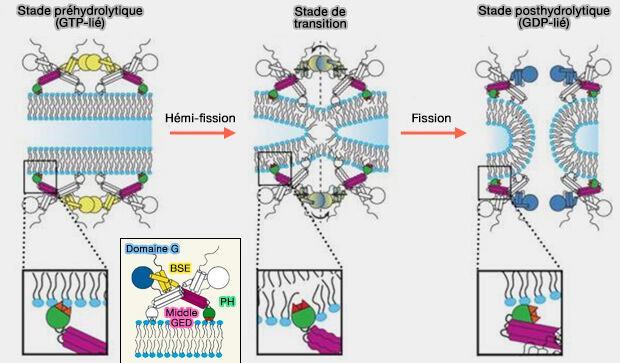
Cette conformation correspond probablement à un état de transition GDP + Pi, lorsque les domaines G des échelons adjacents forment des interactions d'affinité très élevée (A Pseudoatomic Model of the Dynamin Polymer Identifies a Hydrolysis-Dependent Powerstroke 2011).
2. La deuxième étape est l'hydrolyse du GDP qui libère des Pi dans la conformation liée au GDP.
Ce mécanisme désassemblerait l'échafaudage, permettant aux hémifissions de procéder à la fission complète (A hemi-fission intermediate links two mechanistically distinct stages of membrane fission 2015).
- L'état de transition nécessite des interactions de domaines G entre les échelons adjacents de l'hélice de dynamine.
- En effet, le départ de la fission s'effectue sur des hélices légèrement plus grandes que la conformation super-resserrée, 25-30 monomères, 11 dimères par tour (Dynamin-driven membrane fission reveals catalytic principle of membrane remodeling 2013 et Dynamin recruitment and membrane scission at the neck of a clathrin-coated pit 2014).
3. Dans ce modèle, la plus grande partie de l'énergie d'hydrolyse est utilisée :
- pour déstabiliser le polymère, comme c'est le cas pour la tubuline ou l'actine,
- pour assembler les dimères en une conformation super-resserrée dans une hélice plus incurvée.
(Figure : vetopsy.fr d'après Mattila et coll)
Incohérences du modèle en deux étapes

Cependant, des incohérences peuvent apparaître (Membrane fission by dynamin: what we know and what we need to know 2016).
1. Les dimères doivent tous être au même stade d'hydrolyse du GTP, ce qui paraît différer de ce que l'on sait sur l'activité GTPasique de la dynamine, i.e. :
- absence de coopération entre les GTP dans la première étape,
- courte durée de vie des GDP+Pi dans la seconde.
2. La conformation super-resserrée devrait provoquer la fission.
3. Plusieurs solutions ont été envisagées pour résoudre ces incohérences par le domaine PH de la dynamine (
L'inclinaison des domaines PH pourraient resserrer l'hélice en pousser l'hélice plus loin dans le feuillet (A Dynamin Mutant Defines a Superconstricted Prefission State 2014).
Modèle constrictase/cliquet (constrictase/ratchet)
Vue d'ensemble du modèle constrictase/cliquet
Le modèle constrictase/cliquet (constrictase/ratchet) est un modèle de constriction qui propose que la dynamine agisse comme un moteur dans lequel l'énergie de l'hydrolyse du GTP serait dépensée en travail mécanique. (A Pseudoatomic Model of the Dynamin Polymer Identifies a Hydrolysis-Dependent Powerstroke 2011).
- Suite à plusieurs cycles d'hydrolyse du GTP, les spires adjacentes (rung, barreau) glisseraient les unes sur les autres, resserrant activement l'hélice et son tube membranaire jusqu'à ce que ces dernières fissions le ferment complètement.
- Le désassemblage serait alors une conséquence de la disparition du substrat lipidique.
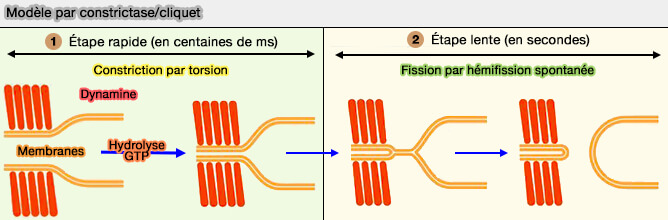
Figure : vetopsy.fr d'après Antonny et coll)
Le mécanisme pourrait être le suivant.
1. Les tétramères de dynamine sont inhibés en solution
2. La liaison membranaire provoque un changement de conformation dans les tétramères pour assembler le collier hélicoïdal de dynamine au col d'une fosse invaginée recouverte de clathrine.
3. La constriction initiale du cou, déclenchée par la liaison GTP et les changements structurels dans la tige médiane/GED, favorise la dimérisation du domaine G entre les tétramères dans les barreaux (rung) hélicoïdaux adjacents pour positionner de manière optimale la machinerie catalytique de la dynamine.
4. L'hydrolyse du GTP stimulée par l'assemblage :
- entraîne une rotation majeure du BSE dans l'état de transition qui constitue le powerstoke de la dynamine,
- provoque une constriction supplémentaire du col.
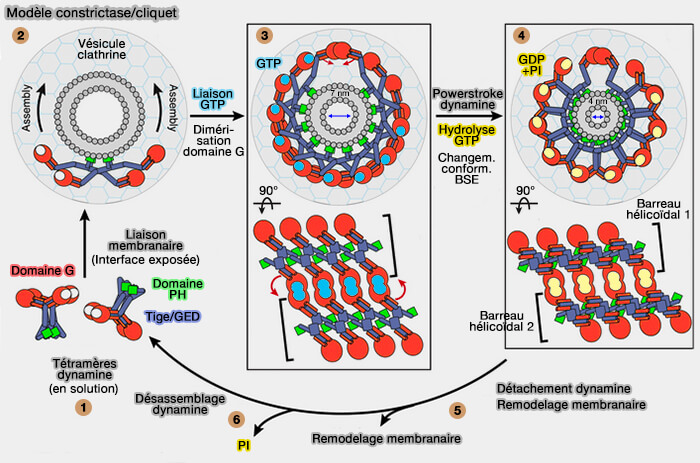
Figure : vetopsy.fr d'après Chappie et coll)
5. Des réarrangements structurels pourraient jouer un rôle dans le détachement de l'échafaudage de dynamine, facilitant les événements de remodelage de la membrane qui contribuent à la fission de la membrane.
6. L'échafaudage de dynamine détaché se désassemble lors de la libération du γ-phosphate hydrolysé.
Poins forts du modèle constrictase/cliquet
1. Dans ce modèle, les domaines GTPase, qui relient la dynamine par des interactions directes, pourraient agir comme des moteurs moléculaires.
- Ce modèle est analogue au mécanisme du mouvement de la myosine sur les filaments d'actine.
- La dynamine joue le rôle de la myosine et de l'actine en même temps (
Liaison myosine/actine).
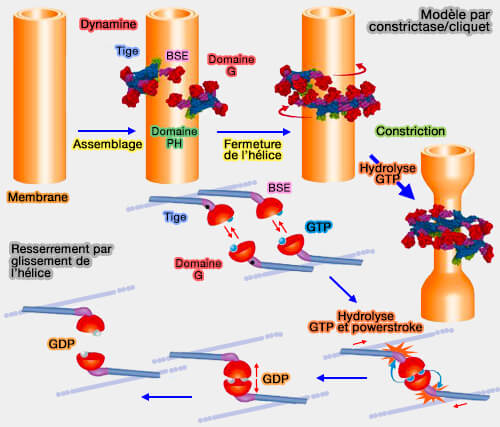
(Figure : vetopsy.fr d'après Antonny et coll)
2. La biochimie de l'activité GTPase est en effet compatible avec une telle activité motrice : elle a une affinité assez faible pour les nucléotides et un taux de GTPase élevé (au moins lorsqu'il est activé par l'assemblage).
3. En outre, l'architecture globale de la dynamine est très similaire à la myosine ou à la kinésine, la tige étant connectée au domaine GTPase par une charnière flexible au BSE (Bundle signaling élément).
- La liaison au GTP induit une trans-dimérisation (entre les spires hélicoïdales) des domaines GTPase via une interface à travers le site de liaison aux nucléotides.
- Le BSE (Bundle signaling élément) adopte une conformation ouverte en présence de GTP, alors qu'une rotation de 70° vers un état fermé a été observée dans l'état de transition ou en l'absence de nucléotide.
Ce mouvement serait le générateur de la force (
Incohérences du modèle constrictase/cliquet

Cependant, des incohérences peuvent apparaître (Membrane fission by dynamin: what we know and what we need to know 2016).
1. Les données structurales obtenues par diffraction des rayons X ne correspondent pas à la densité des tiges dans une hélice ressérée. Le nombre de domaines GTPase qui interagissent est-il suffisant ?
2. Un autre problème est le couplage entre la formation des liaisons G-G à travers les barreaux la constriction qui permet le glissement des spires de l'hélice.
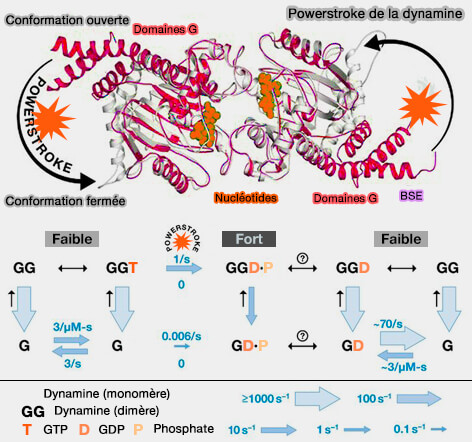
(Figure : vetopsy.fr d'après Antonny et coll)
3. Enfin, dans ce modèle, le désassemblage est plus obscur.
- Soit, une fois la fission survenue, la dynamine pourrait se démonter car le gabarit de la membrane a disparu.
- Soit, les contraintes, apparaissant dans l'hélice de la dynamine sous l'effet de la constriction, pourraient provoquer sa rupture.
Dans ces deux cas, le désassemblage serait une conséquence de la fission et/ou de la constriction, et l'énergie d'hydrolyse du GTP serait principalement dépensée pour générer une force de constriction (travail mécanique).

Ces deux modèles opposés ne sont pas forcément incompatibles, mais un plus grand nombre de données est nécessaire sur la manière dont le cycle GTPase de la dynamine est couplé aux activités (assemblage/désassemblage, interactions membranaires, dimérisation du domaine G, changements conformationnels…) qui conduisent à la fission (
Remarque : Un modèle essaie de reconcilier ces deux modèles (


