Domaines protéiques
Domaines U-Box et Miz

Les domaines U-box, variantes des domaines RING, assurent l’ubiquitination par un mécanisme direct sans coordination de zinc, via un réseau de liaisons hydrogène.
(Figure : vetopsy.fr d'après Wander Kooi)
Les U-box sont des domaines d'environ 70 acides aminés présents depuis la levure (la première découverte est Ufd2) à l'homme (où l’on en dénombre six).
De nombreuses protéines qui contiennent un domaine U-box sont des E3 ubiquitine ligases liées à l'ubiquitination (U Box Proteins as a New Family of Ubiquitin-Protein Ligases 2001).
U-Box
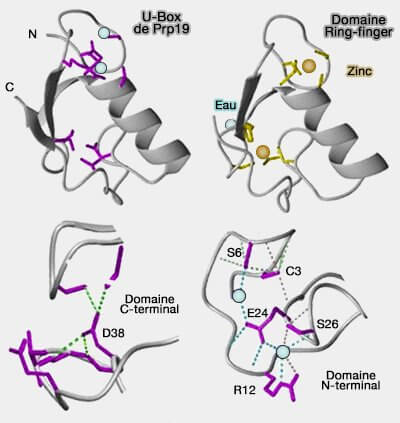
Structure des U-Box
La structure des U-box est proche des domaines RING, à la différence qu’ils ne comportent pas d’ions zinc.
En quelque sorte, ce sont des domaines RING qui ont perdu leur zinc (The U box is a modified RING finger - a common domain in ubiquitination 2000 et Structural insights into the U-box, a domain associated with multi-ubiquitination 2003).
1. Les cystéines ou les histidines sont remplacées par des résidus polaires qui interviennent dans des liaisons hydrogène et de ponts salins qui qui assurent la stabilité du domaine et le maintien de son activité d’ubiquitination (The Prp19 U-box Crystal Structure Suggests a Common Dimeric Architecture for a Class of Oligomeric E3 Ubiquitin Ligases 2008).
a. Le domaine C-terminal est stabilisé par quatre résidus de base, Ser16, Ser19, Asp38, Thr41 (parfois avec Glu43).
Par rapport au domaine RING, Asp38 est plus central.
b. Le domaine N-terminal est plus différent que celui de RING avec cinq résidus (Cys3, Ser6, Arg12, Glu24, Ser26) et deux molécules d'eau.
(Figure : vetopsy.fr d'après Pruneda)
2. Malgré leur différence, les U-box et les domaines RING présentent tous les deux une rainure hydrophobe peu profonde qui interagit directement avec l'enzyme de conjugaison E2 (E2 ubiquitin-conjugating enzyme), garantissant un mécanisme catalytique identique de transfert direct de l’ubiquitine.
Organisation fonctionnelle des U-box
1. De nombreuses E3 ubiquitine ligases forment :
- CHIP (C terminus of HSC70-Interacting Protein), aussi appelée STUB1 (STIP1 homology and U-Box containing protein 1), E3 U-box majeure, agissant en association avec les chaperonnes Hsp70/Hsp90 pour cibler les protéines mal conformées (Interactions between the quality control ubiquitin ligase CHIP and ubiquitin conjugating enzymes 2008),
- Prp19, impliquée dans la formation de complexes oligomériques stables (The Prp19 U-box Crystal Structure Suggests a Common Dimeric Architecture for a Class of Oligomeric E3 Ubiquitin Ligases 2008),
b. des hétérodimères spécifiques par l'interaction entre leurs domaines RING/RING, RING/U-box et U-box/U-box, comme UFD2a/UBE4B : impliquée dans l’extension des chaînes polyubiquitine et la dégradation protéasomale. (Structure of an E3:E2∼Ub Complex Reveals an Allosteric Mechanism Shared among RING/U-box Ligases 2012).
Homologie structurale des U-Box et des RING
Les domaines U-box appartiennent à la grande famille des E3 de type RING, dont ils partagent le mécanisme catalytique direct.
Ils se distinguent des RING uniquement par l’absence de coordination au zinc, remplacée par un réseau de liaisons hydrogène et ioniques assurant la même géométrie fonctionnelle.
| Caractéristique | Domaine RING | Domaine U-box | Exemple représentatif |
|---|---|---|---|
| Famille enzymatique |
RING-type E3 ligase | RING-related E3 ligase |
|
| Stabilisation structurale |
2 ions Zn++ coordonnés par Cys/His |
Liaisons hydrogène et ponts salins |
|
| Mécanisme catalytique |
Transfert direct de l'ubiquitine d'E2~Ub vers le substrat |
Transfert direct sans intermédiaire covalent |
|
| Organisation typique |
Monomérique ou complexe (CRL, APC/C) |
Homo- ou hétérodimérique |
|
| Rôle biologique |
|
Contrôle qualité et repliement des protéines |
|
Domaine Miz
1. Le domaine Miz finger (Myc-Interacting Zinc-finger) est présent dans :
- les PIAS (Protein Inhibitor of Activated STAT) et
- les Siz, sous-familles des E3 ligases qui interviennent dans la sumoylation.
Ce domaine est aussi appelé SP-RING ou Siz/PIAS RING (SP-RING for SUMO: New Functions Bloom for a Ubiquitin-like Protein 2001).
2. Le domaine Miz finger semble être un domaine intermédiaire entre les domaines RING et U-Box (A beta-sheet interaction interface directs the tetramerisation of the Miz-1 POZ domain 2007 et The Prp19 U-box Crystal Structure Suggests a Common Dimeric Architecture for a Class of Oligomeric E3 Ubiquitin Ligases 2008).
- Le domaine N-terminal est stabilisé par des liaisons hydrogène et salines.
- Le domaine C-terminal est stabilisé par des liaisons de chélation du zinc.
Retour aux domaines protéiques
Biologie cellulaire et moléculaireConstituants de la celluleMatrice extracellulaireReproduction cellulaireBiochimieChimie organiqueBioénergétiqueProtidesAcides aminésProtéinesDomaines protéiquesModifications post-traductionnelles des protéinesDégradations des protéinesUbiquitinationGlucidesLipidesEnzymesCoenzymesVitaminesHormonesTransport membranaireMoteurs moléculairesVoies de signalisation


