Domaines protéiques
Domaines protéiques à doigt de zinc
Domaines B-box

Les B-box, dont la structure se rapproche du domaine RING, sont retrouvées dans plus de 1500 protéines et sont impliquées dans l'ubiquitination.
(Figure : vetopsy.fr)

Pour en savoir plus : Solution Structure of the RBCC/TRIM B-box1 Domain of Human MID1: B-box with a RING 2006 et Solution Structure of the MID1 B-box2 CHC(D/C)C2H2 Zinc-binding Domain: Insights into an Evolutionarily Conserved RING Fold 2007 et Structure of the MID1 Tandem B-Boxes Reveals an Interaction Reminiscent of Intermolecular Ring Heterodimers 2008.
Structure
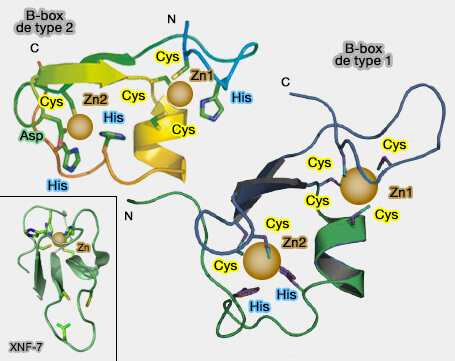
Les B-box, divisées en deux groupes (type 1 et 2), sont riches en cystéine et en histidine.
- Les protéines possèdent soit une simple B-box, en général de type 2 (B2), soit un tandem de B-box de type 1 et 2 (B1B2).
- Elles peuvent être retrouvées dans des protéines qui ne possèdent pas de domaine RING ou de domaine coiled-coil (superhélice).
1. Leur séquence consensus, le type 2 est plus court de quelques 8 résidus, et l'emplacement des résidus qui se lient au zinc est différent.
- B1 : Cys-X2-Cys-X6-17-Cys-X2-Cys-X4-8-Cys-X2-3-Cys/His-X3-4-His-X5-10-His[Cys5(Cys/His)His2].
Liaisons entre B-box de type 2 et 1
(Figure : vetopsy.fr avec l'aimable autorisation de Massiah)
Remarque : certaines B-box de type 2 ne comportent qu'un seul atome de zinc chélaté par 2 cystéines et deux histidines comme XNF7 du xénope (Enhancement of BRCA1 E3 Ubiquitin Ligase Activity through Direct Interaction with the BARD1 Protein 2002).
Une large boucle hydrophobe sans zinc comprend 2 cystéines et un acide aspartique.
2. Par contre, leurs structures secondaire et tertiaire sont similaires (ββα RING-like fold).
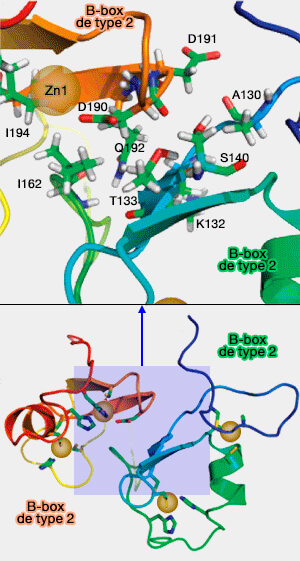
a. Les deux B-box interagissent au moyen d'un faisceau à quatre hélices, chaque protéine fournissant deux hélices : 10 résidus sont impliqués dans cette interaction.
b. La B-box 1 est N-terminale par rapport à la 2, l'ordre étant conservé au cours de l'évolution pour toutes les protéines.
Cette position invariable montre que les 2 B-box coopèrent.
c. La B-box de type 2 tourne alors de 90° par rapport à la B-box de type 1 (Structure of the MID1 Tandem B-Boxes Reveals an Interaction Reminiscent of Intermolecular Ring Heterodimers 2008).
3. Les B-box sont contenues, par exemple, dans le domaine TRIM qui comprend aussi un vrai domaine RING-finger N-terminal comme l'ectodermine/TRIM33.
Rôles
Les B-Box ne peuvent pas recruter l'enzyme de conjugaison E2 (E2 ubiquitin-conjugating enzyme), même si elles sont impliquées dans l'ubiquitination.
Le processus engagé est encore inconnu (Structural insights into the TRIM family of ubiquitin E3 ligases 2014).
Retour aux domaines protéiques
Biologie cellulaire et moléculaireConstituants de la celluleMatrice extracellulaireReproduction cellulaireBiochimieChimie organiqueBioénergétiqueProtidesAcides aminésProtéinesDomaines protéiquesModifications post-traductionnelles des protéinesDégradations des protéinesUbiquitinationGlucidesLipidesEnzymesCoenzymesVitaminesHormonesTransport membranaireMoteurs moléculairesVoies de signalisation


