Messagers intermédiaires
Calmoduline
: rôles
- En construction

La calmoduline (CaM ou Calcium-Modulated protein) est une messager intermédiaire multifonctionnelle de liaison aux ions Ca++ exprimée dans toutes les cellules eucaryotes.
Vue d'ensemble des rôles de la CaM
1. La CaM est la cible du Ca++, considéré comme un second messager dans les processus de transduction du signal intracellulaire dépendant du calcium, qui modifient les interactions avec de nombreuses protéines cibles.

(Figure : vetopsy.fr)
2. Le rôle de la CaM est d'informer les canaux et les transporteurs des modifications de concentration intracellulaire de Ca++ en se liant aux domaines cytoplasmiques de ces protéines pour moduler leur fonction : on parle de calmodulation.

Vous pouvez lire pour une revue :
- Towards a unified theory of calmodulin regulation (calmodulation) of voltage-gated calcium and sodium channels (2015),
- Calmodulation meta-analysis : Predicting calmodulin binding via canonical motif clustering (2014),
- Mechanisms of a Human Skeletal Myotonia Produced by Mutation in the C-Terminus of NaV1.4: Is Ca2+ Regulation Defective ? (2013),
- Structural insights into neuronal K+ channel–calmodulin complexes (2012).
Quand le Ca++ se lie à la CaM, le complexe Ca++/CaM peut ensuite se lier et réguler ses cibles enzymatiques.
CaM et canaux ioniques
La liaison de CaM aux canaux ioniques dépend des canaux ioniques.

(Figure : vetopsy.fr d'après Ben Johny et coll)
1. Dans les Cav, canaux calcium voltage-dépendants, le processus est complexe (

Un chapitre spécial est consacré aux relations de la calmoduline avec les canaux Cav1 et Cav2.
La CaM, sans ions Ca++, est liée au canal :
- par son lobe C-terminal au domaine IQ de l'extrémité C-terminale des Cav,
- par son lobe N-terminal au domaine preIQ ou PCI (proximal Ca++-inactivation), situé en amont, contenant deux mains EF en amont de ce domaine.
Selon l'activation ou l'inactivation du canal, la CaM peut se lier à l'extrémité C-terminale, mais aussi au domaine NSCaTE (N-terminal spatial Ca++ transforming element) de l'extrémité N-terminale.
2. Dans les KCa, canaux potassiques à faible conductance, comme dans les canaux IK ou SK, c'est le lobe C qui se lie de manière constitutive au domaine CaMBD dans la région proximale membranaire de l'extrémité C intracellulaire du canal (CaMBD).
- La structure du CaMBD isolé en complexe avec Ca++/CaM révèle une organisation dimérique de deux CaMBD et deux CaM, avec uniquement les mains E-F du lobe N occupées par les ions Ca++.
- Chaque sous-unité du canal tétramérique lie un CaM, et la liaison et la déliaison des ions Ca++ aux mains-EF du lobe N de CaM provoquent des changements conformationnels pour l'ouverture et la fermeture du canal, respectivement.

(Figure : vetopsy.fr d'après Morales et coll)
3. Dans certains canaux Nav, on trouve aussi des modulations par la calmoduline (Conservation of Ca2+/Calmodulin Regulation across Na and Ca2+ channels 2014).
4. D'autres canaux sont modulés par la CaM :
- les canaux potassiques Kv7 (KCNQ),
- les canaux cycliques à nucléotides (CNG),
- le récepteur au glutamate NMDA (N-méthyl D-aspartate),
- les canaux TRP (Transient Receptor Potential),
- les récepteurs de la ryanodine.
CaM et synapses
1. Au niveau présyaptique, la CaM intervient dans l'activation transitoire de la calcineurine (CaN), protéine phosphatase dépendante du calcium/calmoduline (
La calcineurine déphosphoryle de manière coordonnée de plusieurs substrats différents lors d'une dépolarisation prolongée des terminaisons nerveuses centrales (les déphosphines), comme dans l'endocytose de masse dépendante de l'activité (ADBE), qui jouent tous un rôle essentiel dans l'endocytose des vésicules synaptiques (VS).
C'est le cas, par exemple, de la dynamine, les amphiphysines 1/2, la synaptojanine (Synj), AP180, l'epsine et l'EPS15.
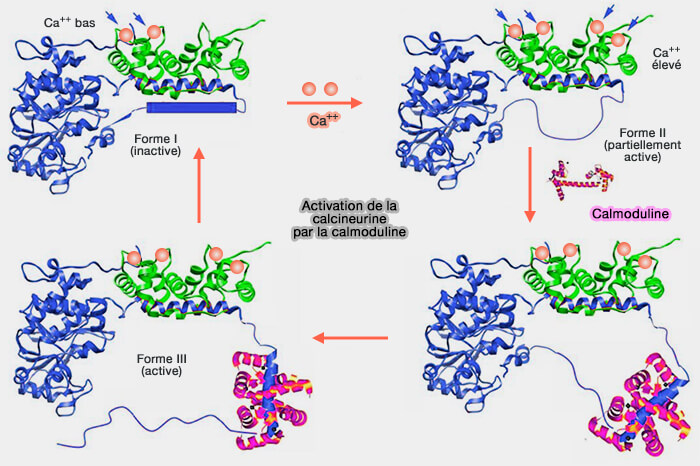
(Figure : vetopsy.fr d'après Li et coll)
2. Une des principales cibles des CaM des épines dendritiques est la protéine kinase II Ca++/CaM-dépendante (CaMKII).
Elle joue un rôle central dans l'initiation de changements synaptiques persistants comme dans (A Dynamic Model of Interactions of Ca2+, Calmodulin, and Catalytic Subunits of Ca2+/Calmodulin-Dependent Protein Kinase II 2010) :
- la potentialisation à long terme (PLT),
- les mécanismes de la plasticité synaptique.
Retour aux seconds messagers
En construction


