Canaux ioniques : canaux sodiques (Na+)
Canaux sodium voltage-dépendants
(Nav) : sous-unités β
Les canaux sodium voltage-dépendants sont formés :
- de sous-unités α, suffisantes pour former le canal Na+ (260 kD) pour le passage des ions,
- de sous-unités β (2 à 4) qui facilitent leur localisation membranaire et permettent la modulation de leurs propriétés.
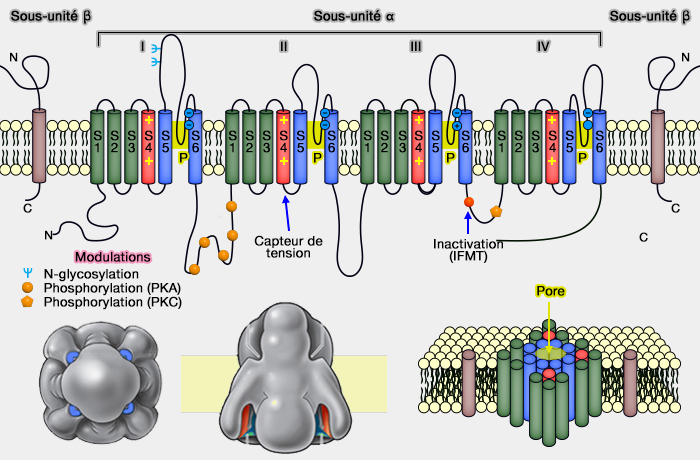
(Figure : vetopsy.fr)
Structure des sous-unités β
Pour les canaux voltage-dépendant, si les sous-unités α sont impliquées dans la conductance ionique, des sous-unités complémentaires en modulent les multiples aspects de leur comportement et jouent un rôle crucial dans le contrôle de l'excitabilité neuronale.
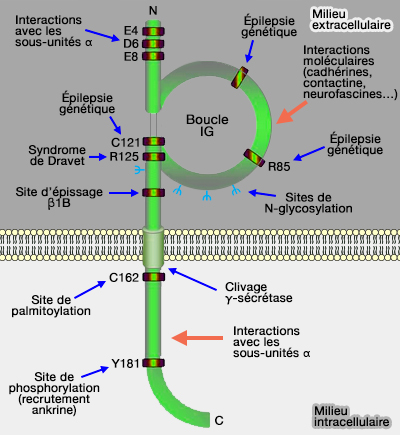
(Figure : vetopsy.fr d'après Brackenbury)

Dans les canaux sodium, ce sont les sous-unités β (A new look at sodium channel β subunits 2015).
Structure générale
Les sous-unités bêta appartiennent à la superfamille des immunoglobulines (IgSF) et, en particulier à la famille des molécules d'adhésion cellulaire (CaM)
- Chez la plupart des vertébrés, on trouve quatre gènes (Scn1b à Scn4b) qui codent les protéines β1-β4, respectivement (Trafficking and Cellular Distribution of Voltage-Gated Sodium Channels 2007).
L'épissage alternatif du gène scn1b produit la viariante β1b (Molecular cloning and functional expression of the human sodium channel β1B subunit, a novel splicing variant of the β1 subunit 2003).
- Ces différentes sous-unités sont exprimées dans les différents tissus (Electrophysiology and Beyond: Multiple roles of Na+ channel β subunits in development and disease 2010).
Ces protéines sont des protéines membranaires intégrales (ou extrinsèques) de type I avec :
- une région extracellulaire N-terminale sui contient :
- un seul domaine immunoglobuline de type V, avec la boucle typique des Ig,
- un domaine court, le cou (" neck "),
- une région transmembranaire, formé d'un seul domaine α-hélicoïdal,
- une région intracellulaire carboxy-terminale.
Les sous-unités bêta ne partagent aucune homologie avec les sous-unités auxilliaires des canaux de calcium et de potassium (From Ionic Currents to Molecular Mechanisms 2000).
Structure des différentes sous-unités β
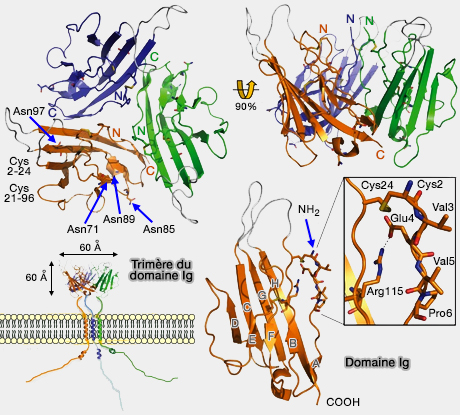
(Figure : vetopsy.fr d'après Namadurai)
Les séquences primaires de β1 et β3 sont les plus proches (Molecular cloning and analysis of zebrafish voltage-gated sodium channel beta subunit genes: implications for the evolution of electrical signaling in vertebrates 2007).
- Les sous-unités β1 et β3 ne sont pas liées de façon covalente à la sous-unité α, les sous-unités β2 et β4 le sont via une liaison disulfure (Identification of the Cysteine Residue Responsible for Disulfide Linkage of Na+ Channel α and β2 Subunits 2012).
- Des études récentes ont résolu les structures des sous-unités β3 et β4 (Crystallographic insights into sodium-channel modulation by the β4 subunit 2013 et Crystal Structure and Molecular Imaging of the Nav Channel β3 Subunit Indicates a Trimeric Assembly 2013).
Ces sous-unités ont tendance à se polymériser, comme dant le cas de la β3 qui se trimèrise (cf. figure ci-contre).
- Le domaine transmembranaire α-hélicoïdal contient un résidu d'acide glutamique hautement conservé qui permet la formation de dimères ou de trimères, stabilisées par des liaisons hydrogène entre les chaînes latérales protonées de l'acide glutamique (glu4).
- Dans la plupart des domaines Ig, les acides aminés amino-terminaux sont maintenus en place par un brin β antiparallèle (
domaine Ig). Dans β3, la région est stabilisée par une liaison disulfure de surface (Cys2-24) et un pont de sel entre les résidus Arg115 et Glu4. Par conséquent, les acides aminés hydrophobes Val3, Val5 et Pro6 sont placés en surface pour former le noyau de l'interface du trimère.
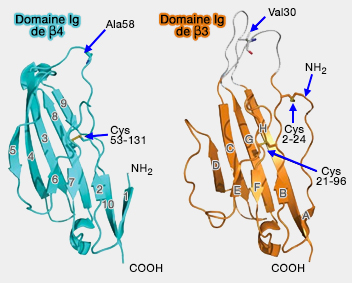
(Figure : vetopsy.fr d'après Namadurai)
Les sous-unités β1 et β3 sont proches et contiennent de nombreux acides aminés communs, et en particulier, les acides aminés de surface, ainsi que l'acide glutamique, ce qui permet leur trimérisation.
Si les sous-unités β3 et β4 ne sont pas proches par leur structure primaire, leur configuration est relativement identique (cf. figure ci-contre). Par contre, β4 semble monomérique in vitro, contrairement à β3, ce qui ne veut pas dire forcément qu'elle ne soit pas oligomérique in vivo.
Fonctions des sous-unités β
Rôles dans la conduction neuronale

Les sous-unités β assument bon nombre des changements conformationnels du canal sodium voltage-dépendant et modulent les multiples aspects du comportement des canaux Nav pour jouer un rôle crucial dans le contrôle de l'excitabilité neuronale.
| Sous-unités β |
Localisation |
|---|---|
| β1 | Coeur, muscle squelettique, système nerveux central, cellules gliales, système nerveux périphérique |
| β1a | Coeur, muscle squelettique, glandes surrénales, système nerveux périphérique |
| β1b | Encéphale humain, moelle épinière, ganglion de la racine dorsale, neurones corticaux, muscle squelettique |
| β2 | système nerveux central et périphérique, coeur |
| β3 | Système nerveux central, glandes surrénales, rein, système nerveux périphérique |
| β4 | Coeur, muscle squelettique, système nerveux central et périphérique |
Les mutations des sous-unités β sont associées à un certain nombre de maladies héréditaires comme l'épilepsie, les neuropathies, les maladies de la conduction cardiaque et certains types de cancer (Na+ Channel β Subunits: Overachievers of the Ion Channel Family 2011 et Regulatory Role of Voltage-Gated Na+ Channel β Subunits in Sensory Neurons 2011).
- 1. Les sous-unités β peuvent augmenter la densité de courant maximale en augmentant le nombre de canaux dans la membrane de plasma (dépolarisation active : cycle de Hodgkin).
- 2. Elles modifient le potentiel membranaire permettant ainsi l'activation et l'inactivation du canal.
- 3. Elles augmentent la fréquence des inactivations et de la récupération de l'inactivation (Distinct domains of the sodium channel β3-subunit modulate channel-gating kinetics and subcellular location 2005).
Autres rôles
Ces sous-unités β jouent également d'autres rôles.
1. Elles peuvent se lier aux protéines du cytosquelette, via l'ankyrine et la spectrine.
Elles interviennent alors dans le développement embryonnaire et la transduction du signal, en particulier dans les organes des sens (The Role of Non-pore-Forming β Subunits in Physiology and Pathophysiology of Voltage-Gated Sodium Channels 2014).
2. Elles peuvent se lier à de nombreuses protéines pour moduler l'expression ou la fonction du canal sodium.


