Domaines protéiques
Domaine WH

Le domaine WH (Winged Helix) est un sous-type de la famille HTH (Helix-Turn-Helix).
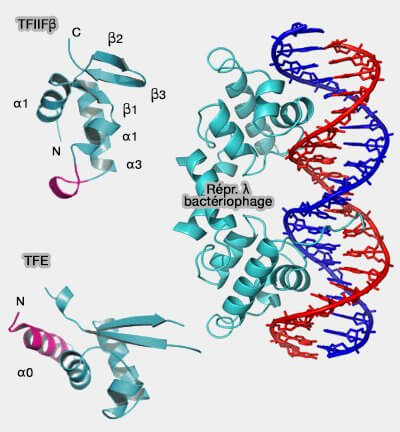
(Figure : vetopsy.fr d'après Teichmann et Zephris)
Ce domaine est trouvé, sur le site vetopsy.fr, dans :
- les Fox (ou FAST) qui participent au recrutement du complexe Smad2/Smad4,
- dans les sous-unités de ESCRT-II, complexe de tri endosomal.
Structure du
domaine WH
1. Le domaine WH (Winged Helix) est formé de :
- trois hélices α (de 1 à 3), l'hélice α3 est particulièrement conservée,
- trois feuillets β (β sheet) selon un ordre précis : α1, β1, α2, α3, β2, β3.
Deux boucles spécifiques, qui font la spécificité de ce domaine, sont situées :
- avant hélice α1 (α0), comme dans le TFE (Archeal Transcription Factor),
- entre l'hélice α2 et α3, comme dans TFIIF-β (Transcription factor II β).
2. Ce domaine est retrouvé aussi bien chez les Protocaryotes que chez les Eucaryotes.
Fonctions du domaine WH
1. Les boucles définissent la spécificité du domaine pour réguler la transcription de l'ADN.
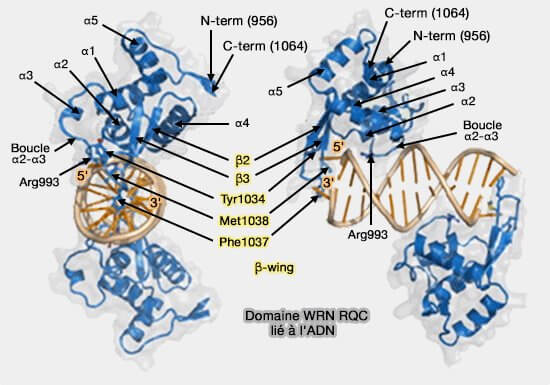
(Figure : vetopsy.fr d'après Kitano sous Open Archive)
2. Toutefois, ces dernières années, les études ont montré que le domaine WH ne se limite pas à ce rôle, car il intervient aussi dans :
- les interactions protéine/protéine,
- la reconnaissance des ARN,
- la reconnaissance d'autres domaines de complexe comme ceux de la condensine (impliquée dans la condensation chromosomique avant la mitose),
- l'ouverture directe de l'ADN par une boucle spécifique (β-wing), entre les brins β2 et β3 (Structural Basis for DNA Strand Separation by the Unconventional Winged-Helix Domain of RecQ Helicase WRN 2010).
Retour aux domaines protéiques
Biologie cellulaire et moléculaireConstituants de la celluleMatrice extracellulaireReproduction cellulaireBiochimieChimie organiqueBioénergétiqueProtidesAcides aminésProtéinesDomaines protéiquesModifications post-traductionnelles des protéinesDégradations des protéinesUbiquitinationGlucidesLipidesEnzymesCoenzymesVitaminesHormonesTransport membranaireMoteurs moléculairesVoies de signalisation


