Isomérie : stéréoisomérie de configuration
Vue d'ensemble
Carbone asymétrique, notation CIP et chiralité
- Biologie cellulaire et moléculaire
- Biochimie

Les stéréoisomères de configuration sont des isomères à même formule développée, mais qui nécessitent une rupture de liaison pour passer de l'un à l'autre.
Il existe deux types de stéréoisomérie :
- la stéréoisomérie de conformation (ou conformérie), i.e. stéréisomères qui ne se différencient que par la rotation autour d'une liaison simple (liaison σ), c'est-à-dire sans rupture de liaisons,
- la stéréoisomérie de configuration.
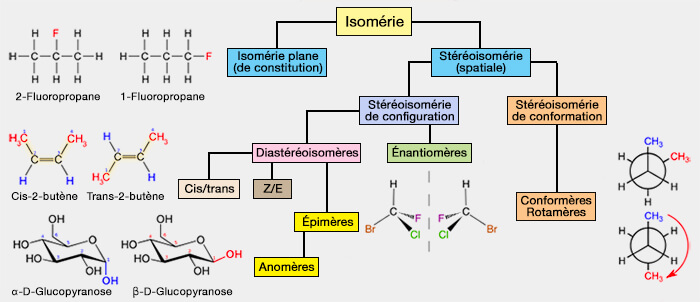
(Figure : vetopsy.fr)
Vue d'ensemble des stéréoisoméries de configuration

Deux stéréoisomères (même formule semi-développée mais structures spatiales différentes) sont dits stéréoisomères de configuration s’il est nécessaire de rompre des liaisons pour passer de l’un à l’autre.
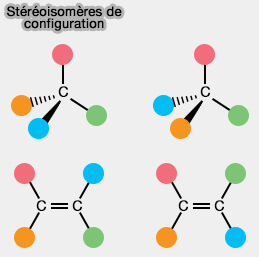
(Figure : vetopsy.fr)
Prenons l'exemple d'une molécule avec une liaison $\ce{C=C}$, cette liaison $\ce{π}$ provoque une rigidité moléculaire qui empêche toute rotation autour d'elle.
La configuration versus conformation est une disposition de groupes substituants différents sur un carbone donné.
- Cette rupture de liaison nécessite donc une forte énergie (200 kJ.mol–1), non disponibles par l'agitation thermique.
- On pourra donc les isoler facilement.
Notions essentielles pour
bien comprendre
Certaines notions sont indispensables pour comprendre les isoméries de configuration !
Carbone asymétrique
Définition

En chimie organique, un atome de carbone asymétrique (centre asymétrique ou carbone chiral ou carbone substitué asymétriquement) est un carbone tétraédrique qui possède quatre substituants de natures différentes.
1. Des exemples sont donnés par l'acide aminé de la figure ci-contre ou les stéréoisomères de configuration de la première figure.
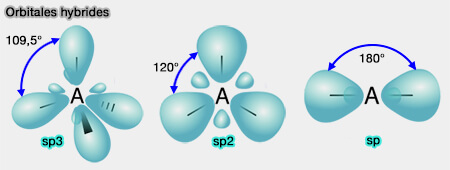
2. Le carbone asymétrique est hybridé sp3.
(Figure : vetopsy.fr d'après Jfmelero)
L'hybridation des orbitales atomiques est le mélange des orbitales atomiques d'un atome appartenant à la même couche électronique de manière à former de nouvelles orbitales qui permettent mieux de décrire qualitativement les liaisons entre atomes.
- Dans le cas idéal, les orbitales adoptent la géométrie la plus symétrique possible .
- La symétrie est l'un des principaux facteurs induisant la dégénérescence des niveaux d'énergie, comme c'est le cas pour les orbitales hybrides qui ont toute la même énergie (
mécanique quantique).
Règles de Cahn-Ingold-Prelog (CIP)
En chimie organique, les règles de priorité de Cahn, Ingold et Prelog (conventions CIP), du nom des chimistes Robert Sidney Cahn (1899-1981), Christopher Kelk Ingold (1893-1970) et Vladimir Prelog (1906-1998), sont un ensemble de lois utilisées pour nommer des stéréoisomères de manière univoque.
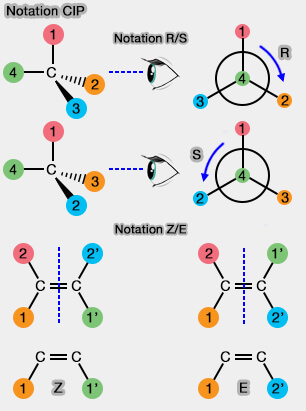
(Figure : vetopsy.fr)
Le but du système CIP est d'assigner :
- une notation R/S à chaque centre stéréogène, i.e. en général, un carbone asymétrique (C*) ;
- une notation Z/E à chaque liaison double.

Pour les règles de la configuration du centre asymétrique ou stéréogène (
1. Dans la notation R/S, les règles sont relativement simples, mais encore faut-il les connaître !
a. Sans rentrer dans les détails, la règle principale est de classer les quatre atomes liés au C* par ordre atomique décroissant.
Vous pourrez voir des exemples et les règles suivantes si des atomes sont identiques, par exemple 2 C reliés au C* (
b. On regarde ensuite la molécule avec le C4 en arrière. Puis, on voit si pour passer du 1 au 2 on tourne :
- à droite, i.e. notation R (Rectus ou droit en français) ;
- à gauche, i.e. notation S (Sinistrus ou gauche en français).
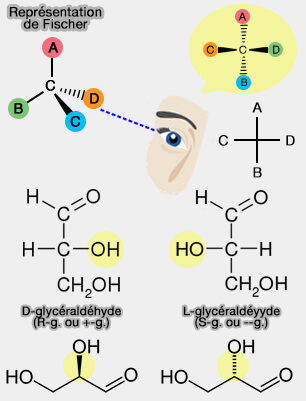
(Figure : vetopsy.fr d'après Jfmelero)
2. Dans la notation Z/E, relative à une double liaison, c'est encore plus simple !
- On classe les 2 atomes de chaque côté de la double liaison par la notation R/S (1, 2 et 1', 2').
- On regarde les deux groupes prioritaires :
- s'ils sont tous les deux du même côté, la double liaison est dite Z (de l'allemand, " Zusammen ", ensemble) ;
- s'ils sont de chaque côté, ll'isomère est E (de l'allemand " Entgegen ", opposé).
La nomenclature D/L utilisée surtout pour les oses n'a rien à voir avec le pouvoir rotatoire, à part pour le glycéraldéhyde.
Chiralité
Définition

Une molécule est dite chirale (du grec kheir, " main "), si et seulement si elle n’est pas superposable à son image dans un miroir plan.
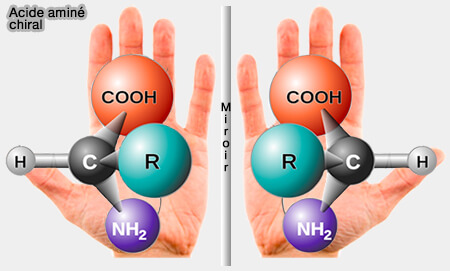
(Figure : vetopsy.fr)
1. Une définition beaucoup plus mathématique (
- La condition nécessaire, mais non suffisante est qu'une molécule chirale ne possède ni plan ni centre de symétrie (si une molécule possède un plan ou un centre de symétrie alors elle n’est pas chirale).
- La condition suffisante de chiralité (mais non nécessaire) est qu'une une molécule possédant un seul carbone asymétrique (noté C*) est une molécule chirale.
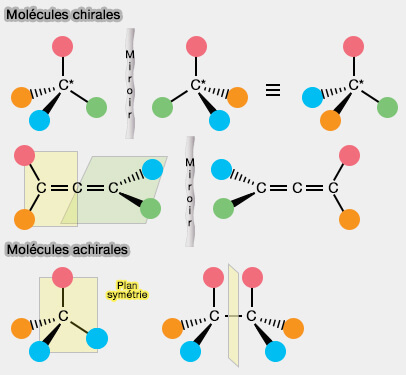
(Figure : vetopsy.fr)
2. Presque toutes les molécules biologiques sont chirales et quelques remarques s'imposent.
- a. Une molécule chirale ne contient donc pas obligatoirement de C*.
- b. Une molécule dont le carbone, par exemple lors de liaison double, ne sont pas dans le même plan, peut être chirale même si elle ne possède pas de C*.
- c. Si une molécule possède plusieurs C*, on trouve un plan de symétrie, i.e., la molécule ne peut être chirale.
Causes de la chiralité
La chiralité peut donc être due :
1. à un centre stéréogène, centre de chiralité ou centre asymétrique,
- i.e. atome comme C* ou carbone asymétrique ou groupe d'atomes sur lequel la permutation de deux de ses substituants, génère deux stéréoisomères (énantiomères ou diastéréoisomères) ;
- tout atome présentant une structure tétraédrique induit une chiralité ; cependant, les énantiomères ne sont pas toujours séparables notamment quand la barrière d’inversion entre les deux formes est faible comme dans le cas de l’azote.
2. à un axe de chiralité,
- i.e. axe autour duquel des substituants sont dans une disposition spatiale fixe qui n'est pas superposable à son image dans un miroir comme les allènes, les biphényles ou les spiranes ;
- en outre, pour les biphényles, l'encombrement stérique entre en jeu pour induire la torsion et favoriser la stabilité des deux formes énantiomères ;
3. à un plan de chiralité, i.e. la molécule doit avoir une partie de ses atomes dans un plan et une autre partie en dehors du plan comme les cyclophanes.
4. à l'hélicité, i.e. on définit une hélice gauche (sens anti-horaire) et une hélice droite (sens horaire), énantiomère l’une de l’autre (
Énantiomères et diastéréoisomères
Biologie cellulaire et moléculaireConstituants de la celluleMatrice extracellulaireReproduction cellulaireBiochimieChimie organiqueBioénergétiqueProtidesAcides aminésProtéinesAcides nucléiquesGlucidesLipidesEnzymesCoenzymesVitaminesHormonesComposés inorganiquesTransport membranaireMoteurs moléculairesVoies de signalisation


