Cytosquelette
Filaments intermédiaires (IF) : remodelage du réseau
- Biologie cellulaire et moléculaire
- Constituants de la cellule
- Matrice extracellulaire
- Reproduction cellulaire
- Biochimie
- Transport membranaire
- Moteurs moléculaires
- Voies de signalisation

Le remodelage du réseau des filaments intermédiaires correspond à une réorganisation contrôlée d’un cytosquelette stable, permettant l’adaptation mécanique et fonctionnelle de la cellule.
Le remodelage du réseau de filaments intermédiaires diffère de celui des autres éléments du cytosquelette, filaments d'actine et microtubules, par une stabilité élevée et une dynamique apparente plus faible.
- Les filaments intermédiaires présentent en effet une demi-vie longue, pouvant atteindre plusieurs semaines voire plusieurs mois, et sont difficilement solubles comparativement aux autres polymères cytosquelettiques.
- Sur le plan structural, ils s’assemblent spontanément sans nécessiter de protéines chaperonnes ni de source énergétique, ce qui contribue à la robustesse et à la continuité du réseau en interphase.
Malgré cette stabilité, les réseaux de filaments intermédiaires subissent des réarrangements contrôlés lors de nombreux processus cellulaires (
Nature dynamique des réseaux d’IF
Contrairement aux filaments d’actine et aux microtubules, les filaments intermédiaires constituent des structures ouvertes, dont l’organisation interne n’est pas strictement figée (
La section d’un même filament peut contenir un nombre variable de tétramères, et cette composition peut évoluer dans le temps, avec des régions localement plus ou moins denses en molécules.
1. Les filaments intermédiaires ne s’allongent pas uniquement par leurs extrémités (Direct Observation of Subunit Exchange along Mature Vimentin Intermediate Filaments 2014).
- Ils peuvent croître ou se remodeler par incorporation latérale d’ULF directement au sein du filament.
- Réciproquement, des ULF peuvent se détacher localement d’un filament et rejoindre un pool soluble, avant d’être réincorporés ailleurs dans le réseau.

Ce processus, non homogène le long du filament, est appelé appelé " dynamic subunit exchange ".
2. Ce mécanisme confère aux filaments intermédiaires une dynamique lente mais continue, compatible avec leur rôle structural.
Modifications post-traductionnelles et remodelage
Le remodelage des filaments intermédiaires repose en grande partie sur des modifications post-traductionnelles, principalement la phosphorylation, mais aussi la glycosylation.
La tige centrale n’est pas phosphorylée, car la structure coiled-coil limite l’accès des kinases (‘Heads and tails’ of intermediate filament phosphorylation: multiple sites and functional insights 2006).
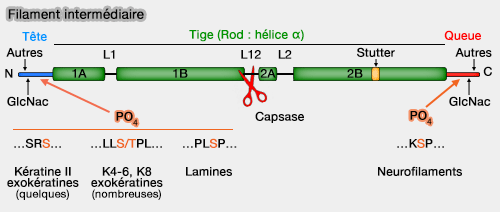
(Figure : vetopsy.fr d'après Omary)
1. Les phosphorylations et déphosphorylations, assurées par de nombreuses kinases et phosphatases, modulent la solubilité, la conformation et l’organisation du réseau d’IF.
Les motifs consensus spécifiques ont été décrits, les phosphorylations se concentrant sur les sérines :
- Ser-Arg-Ser-Xaa dans les kératines de type II,
- Leu-Leu-Ser/Thr-Pro-Leu dans certaines kératines (K4-6, K8, cheveux),
- Pro-Leu-Ser-Pro dans les lamines, essentiel à la mitose,
- répétitions KSP (Lys-Ser-Pro) dans la queue de plusieurs IF.
2. La phosphorylation des filaments intermédiaires provoque leur désassemblage pour former des oligomères solubles ou tétramères qui contribuent à la nature dynamique et la fonction des filaments intermédiares soit directement, soit par l'intermédiaire d'une interaction avec les IFAP (Intermediate Filament Associated Protein).
Rôles du remodelage du réseau des IF
Remodelage du réseau des IF lors de la mitose
Les filaments intermédiaires ne participent pas directement à la formation du fuseau mitotique, n’interviennent ni dans l’organisation des microtubules du fuseau, ni dans la capture ou la ségrégation chromosomique.
Leur rôle pendant la mitose est donc indirect et consiste à se retirer temporairement du paysage mécanique cellulaire afin de permettre au fuseau de fonctionner correctement.
1. En interphase, les filaments intermédiaires forment un réseau dense et continu qui traverse le cytoplasme et assure la résistance mécanique de la cellule, maintient sa forme et relie le cytosquelette aux jonctions cellulaires, aux organites et au noyau.
Les filaments intermédiaires sont ancrés aux desmosomes, aux hémidesmosomes et, indirectement, aux adhérences focales et au noyau.
2. Lors de l’entrée en mitose, la cellule s’arrondit, perd une partie de ses adhérences et réorganise complètement son réseau de microtubules afin de former le fuseau mitotique.
a. Dans ce contexte, un réseau rigide de filaments intermédiaires deviendrait un obstacle mécanique à ces réarrangements.
b. Pour éviter cela, les filaments intermédiaires sont transitoirement désorganisés, principalement par la phosphorylation par les kinases mitotiques, complexe cycline B/CDK1 (MPF), Plk1 et Aurora B, ce qui affaiblit leurs interactions latérales et leurs points d’ancrage et rend la cellule plus déformable et mieux adaptée aux contraintes de la mitose.
- La phosphorylation de la tête N-terminale réduit les interactions entre filaments voisins.
Le réseau devient alors plus lâche et fragmenté, ce qui diminue la rigidité globale du cytoplasme, ce qui facilite l’arrondissement cellulaire et la réorganisation interne nécessaire à la division.
- La phosphorylation de la queue C-terminale modifie, quant à elle, les interactions des filaments intermédiaires avec les autres éléments du cytosquelette.
Les liens mécaniques avec les microfilaments d’actine, les microtubules interphasiques et les jonctions cellulaires sont partiellement relâchés.
3. À la sortie de mitose, les phosphorylations sont levées par les phosphatases PP1 et PP2A et les filaments intermédiaires se réassemblent progressivement et reconstituent un réseau continu dans les cellules filles, rétablissant la résistance mécanique et l’architecture cellulaire.
Remodelage du réseau de kératine dans les cellules épithéliales
2. Dans les cellules épithéliales, par exemple, le remodelage des filaments de kératine suit un cycle spatialement organisé.
a. La nucléation des oligomères solubles se produit préférentiellement à la périphérie cellulaire, au niveau du réseau d’actine ou à proximité des adhérences focales.
b. Les particules s’allongent ensuite (élongation) et sont transportées vers le centre de la cellule par un mécanisme dépendant de l’actine, avant de s’intégrer au réseau existant (Cytoskeleton in motion: the dynamics of keratin intermediate filaments in epithelia 2011).
- Lors de ce transport, les filaments peuvent se regrouper et former des structures plus épaisses.
- Ils peuvent également être démontés par phosphorylation ou ubiquitination, entrer dans un pool soluble, puis être réutilisés dans un nouveau cycle périphérique.
Selon les conditions cellulaires, les processus de montage et de démontage peuvent coexister, l’un dominant l’autre.
c. Une fraction du réseau peut enfin se stabiliser durablement (maturation), par exemple sous la forme d’une cage périnucléaire stable.
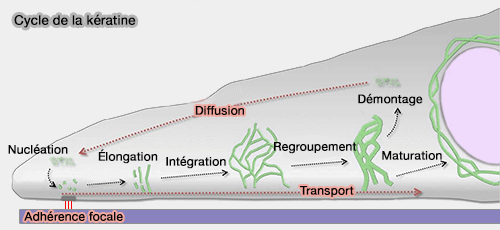
(Figure : vetopsy.fr d'après Windoffer)
Autres rôles du remodelage du réseau des IF
Le remodelage du réseau de filaments intermédiaires confère à la cellule une plasticité mécanique compatible avec des changements rapides de forme, de polarité et de contraintes, sans compromettre l’intégrité structurale globale du cytosquelette.
1. Au cours de la migration, le réseau de filaments intermédiaires, en particulier la vimentine, subit un remodelage spatial marqué.
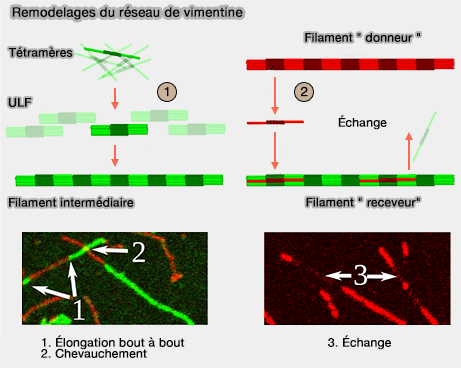
(Figure : vetopsy.fr d'après Nöding)
a. La phosphorylation des domaines N-terminaux favorise un désassemblage local et une réorganisation des ULF, permettant une redistribution asymétrique du réseau entre le pôle avant et le pôle arrière de la cellule migrante.
Ce remodelage accompagne la polarisation cellulaire, facilite la déformation du cytoplasme et permet l’adaptation dynamique du maillage des IF aux forces générées par l’actine et les microtubules.
b. Dans ce contexte, la modulation des interactions de la queue C-terminale avec des protéines adaptatrices de type plakines contribue au couplage contrôlé entre filaments intermédiaires, microfilaments d’actine et microtubules, assurant une coordination mécanique entre les différents réseaux cytosquelettiques.
2. En réponse à des contraintes mécaniques telles que l’étirement ou la compression, le réseau de filaments intermédiaires se réorganise localement afin d’absorber et de redistribuer les forces appliquées à la cellule.
a. Le désassemblage partiel et la réincorporation d’ULF permettent un ajustement du maillage sans rupture du réseau.
La phosphorylation de la queue C-terminale régule alors l’interaction des IF avec les microfilaments d’actine, les microtubules et les complexes d’adhérence via des protéines adaptatrices (plectine, BPAG1/dystonine), favorisant la transmission des contraintes mécaniques à l’échelle cellulaire et tissulaire.
b. Ce couplage dynamique permet au réseau d’IF de jouer un rôle central dans la résistance mécanique, tout en conservant une capacité d’adaptation rapide aux variations de l’environnement physique.
3. Ce couplage dynamique du réseau d’IF au cytosquelette favorise également le transport intracellulaire, notamment le transport axonal.
- Dans les neurones, l’ancrage des neurofilaments aux microtubules via des protéines adaptatrices telles que la plectine et la dystonine permet de stabiliser l’architecture axonale tout en autorisant le déplacement coordonné des composants cytosquelettiques le long de l’axone.
- Ce mécanisme contribue au maintien du calibre axonal et à l’organisation fonctionnelle du cytosquelette neuronal.
IFAP (Intermediate Filament Associated Protein)
Biologie cellulaire et moléculaireMembrane plasmiqueNoyauCytoplasmeMitochondriesSystème endomembranaireRéticulum endoplasmiqueAppareil de GolgiEndosomesLysosomesPeroxysomesProtéasomesCytosquelettemicrofilaments d'actineFilaments intermédiairesIFAPLaminesMicrotubulesMatrice extracellulaireReproduction cellulaireBiochimieTransport membranaire Moteurs moléculairesVoies de signalisation


