Domaines protéiques à doigt de zinc
Domaine Ring-finger
- Biologie cellulaire et moléculaire
- Constituants de la cellule
- Matrice extracellulaire
- Reproduction cellulaire
- Biochimie
- Composition de la matière vivante
- Composés organiques
- Protides
- Acides aminés
- Structure des protéines
- Domaines des protéines
- Modifications post-traductionnelles
- Acides nucléiques
- Glucides
- Lipides
- Vitamines
- Enzymes
- Coenzymes
- Hormones
- Protides
- Composés inorganiques
- Composés organiques
- Composition de la matière vivante
- Transport membranaire
- Moteurs moléculaires
- Voies de signalisation
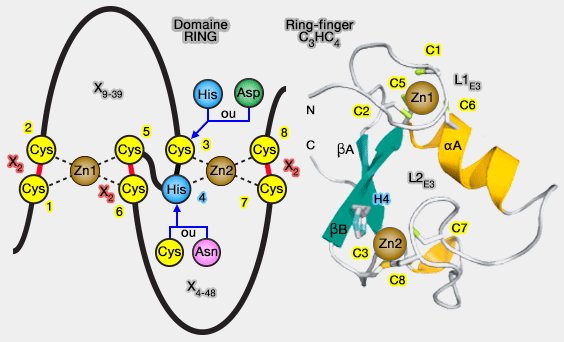
Le domaine RING (Really Interesting New Gene)-finger est un domaine de structure Cys3HisCys4 qui se lie à deux Zn++.
De nombreuses protéines qui contiennent un domaine RING sont des E3 ubiquitine ligases liées à l'ubiquitination.
Structure
Ce domaine protéique contient de 40 à 60 acides aminés (RING Domain E3 Ubiquitin Ligases 2009).
1. La motif consensus est : Cys-X2-Cys-X9-39-Cys-X1-3-His-X1-3-Cys-X2-Cys-X4-48-Cys-X2-Cys.
(Figure : vetopsy.fr)
Cependant, on trouve des variantes, comme dans d'autres domaines contenant des Zn++comme le domaine LIM, où une cystéine ou une histidine est remplacée par un autre résidu, en particulier Asp en 8 dans ROC1/Rbx1 (Structure of the cul1-rbx1-skp1-f boxskp2 scf ubiquitin ligase complex 2000).
2. Le domaine RING adopte une conformation compacte, appelée ββα RING-like fold, comprenant (RINGs hold the key to ubiquitin transfer 2012) :
- deux brins β (βA et βB),
- une hélice α,
- deux boucles qui entourent les ions zinc (boucle ou loop 1 : L1E3, boucle ou loop 2 : L2E3).
Le domaine RING peut être considéré comme un domaine zinc-finger treble clef, entrelacé avec un domaine zinc-ribbon (domaine rubredoxin-like) : il est proche d'autres domaines comme le domaine UBR-box (cf.figure).
Les résidus cystéine et histidine sont enfouis au sein du noyau hydrophobe du domaine.
- Les liaisons avec les deux Zn++ permettent de stabiliser la structure globale de la protéine comme les motifs à doigt de zinc.
-
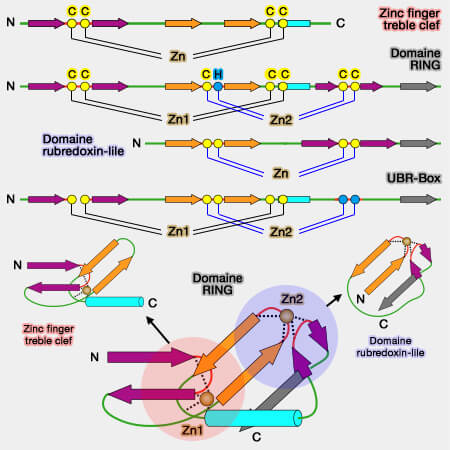
Domaine RING et UBR-Box
(Figure : vetopsy.fr)
Les domaines LIM et PHD ont une structure semblable, mais leur repliement est différent et ils ne participent pas à l'ubiquitination.
Rôles
Les domaines RING, comme les U-box, sont des domaines intégrés dans les E3 ubiquitine ligases.
- La famille RING, comme la famille des U-box par ailleurs, facilitent le transfert de l'ubiquitine par l'orientation spatiale précise de l'enzyme de conjugaison E2 (E2 ubiquitin-conjugating enzyme) par rapport au substrat et catalysent le transfert direct de l'ubiquitine au groupe ε-amine de la lysine du substrat.
- Par contre, la famille HECT et la famille RBR effectue ce processus en deux étapes : l'ubiquitine est d'abord transférée de l'E2 à un site cystéine actif dans l'E3, puis de l'E3 au substrat.
Domaines proches du Domaine RING
Certains domaines, proches des domaines RING, sont :
- les domaines LIM,
- les domaines PHD,
- les B-box,
- les domaines FYVE,
- les domaines ZZ,
- les U-Box,
- les domaine Miz,
- les UBR-Box.
Biologie cellulaire et moléculaireConstituants de la celluleMatrice extracellulaireReproduction cellulaireBiochimieProtidesAcides aminésStructure des protéinesDomaines des protéinesDomaines d'interaction membranaireMotifs à doigt de zincDomaine RINGGlucidesLipidesEnzymesHormonesTransport membranaireMoteurs moléculairesVoies de signalisation


