Enzymes
Vue d'ensemble
- Biochimie
- Transport membranaire
- Moteurs moléculaires
- Voies de signalisation

Une enzyme est une protéine dotée de propriétés catalytiques.
La catalyse (du grec Katalysis, détacher) se réfère à l'accélération ou réorientation de la cinétique de réaction au moyen d'un catalyseur, et même la direction de la réaction dans un sens privilégié.
Pratiquement toutes les biomolécules capables de catalyser des réactions chimiques dans les cellules sont des enzymes.
Toutefois, certaines biomolécules catalytiques sont constituées d'ARN et sont donc distinctes des enzymes : ce sont les ribozymes, découverts en 1980, dont le nom est formé d'après les mots " acide ribonucléique " et " enzyme ".
- En effet, l'ARN peut se replier pour former une structure compacte, qui, en formant de cavités, offrent des sites de fixation aux ligands. Des groupements réactifs qui sont alors réorientés catalysent le substrat.
- En outre, l'ARN, qui peut jouer le rôle de catalyseur et de support de l'information génétique, comme l'ADN, pourrait être à l'origine d'un monde prébiotique où il aurait été le précurseur de toutes les fonctions biologiques. C'est l'hypothèse dite du monde à ARN (
RNA world).
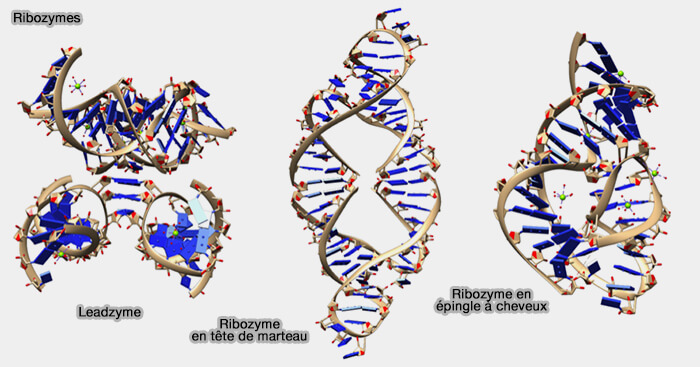
(Figure : vetopsy.fr d'après Lucasharr)
Structure fonctionnelle des enzymes
Quelques définitions indispensables
1. Une enzyme est constituée:
- toujours de l'apoenzyme, fraction protéique thermolabile,
- dans certains cas, d'un cofacteur appelé coenzyme, composé organique non protéique et thermostable qui comprend différents types et modes d'intervention (
coenzymes).
L'enzyme complète avec son coenzyme est appelée alors holoenzyme.
2. Un zymogène ou proenzyme est un précurseur inactif d'une enzyme.
Un zymogène nécessite des changements pour révéler le site actif.
- un changement biochimique, qui se produit généralement dans l'appareil de Golgi, où une partie spécifique de l'enzyme précurseur est hydrolysée,
- un changement de configuration.
Vue d'ensemble
(Figure : vetopsy.fr d'après Thomas Shafee)
Dans cette partie générale, on ne parlera que de l'apoenzyme.
1. L'enzyme doit reconnaître son substrat, s'y combiner transitoirement et le transformer.
- La combinaison enzyme/substrat est un complexe stéréospécifique formé grâce à des liaisons faibles, non covalentes, qui ne peuvent s'engager qu'en raison d'une complémentarité structurale.
- Dans certains cas, des liaisons covalentes se forment de façon transitoire à l'un ou plusieurs des stades de la réaction enzymatique.
2. Dans la plupart des cas, la molécule de protéine enzymatique est infiniment plus volumineuse que celle du substrat.
- Seul, le site actif, zone privilégiée de la protéine qui peut être constituée que de quelques résidus intervient réellement dans la réaction.
- Ces résidus peuvent être très éloignés les uns des autres dans la structure primaire de la protéine, mais se trouvent rapprochés dans l'espace grâce aux repliements de la structure de l'enzyme.
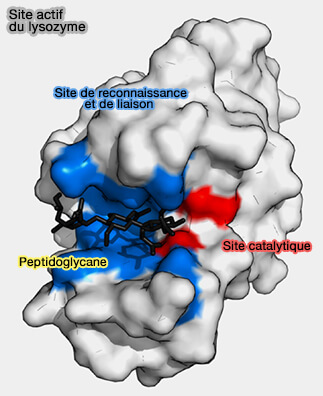
Site actif
Le site actif comporte deux sites voisins :
- le site de reconnaissance, site de fixation du substrat,
- le site catalytique, site responsable de la réalisation de la réaction chimique catalysée.
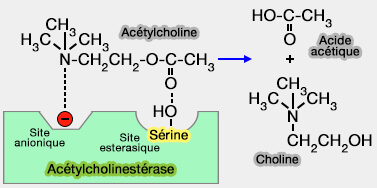
Par exemple, la cholinestérase, enzyme hydrolysant l'acétylcholine, possède :
- un site anionique chargé négativement, qui reconnaît et fixe la partie du substrat à charge positive,
- un site " estérasique " comportant deux groupes réactionnels :
- un hydroxyle électrophile d'une sérine,
- un noyau imidazole nucléophile d'un résidu histidine, qui sont mis en jeu pour l'hydrolyse de la fonction ester.
(Figure : vetopsy.fr)
1. Le site actif d'une enzyme se trouve à l'intérieur de la molécule globulaire protéique, en général dans une sorte de gouttière, i.e. au sein d'un environnement hydrophobe où des échanges électroniques avec le substrat peuvent se réaliser facilement.
- Les quelques résidus impliqués directement dans la réaction enzymatique se trouvent, au niveau du site actif, au contact du substrat et sont, le plus souvent, hautement conservés.
- Des résidus jouent un rôle indirect en assurant la flexibilité de la structure tertiaire au voisinage du site actif.
- D'autres ne paraissent jouer aucun rôle et sont hautement variables.
2. Lors de la reconnaissance, des modifications conformationnelles de la protéine orientent, de manière optimale, les groupes catalytiques, pour optimiser la réaction.
3. Les enzymes agissent, de façon comparable à celle d'un catalyseur minéral, en abaissant l'énergie d'activation des molécules, permettant la réalisation de nombreuses réactions chimiques dans des conditions physiologiques.
Effet accélérateur
Le facteur d'accélération par rapport à la réaction chimique sans catalyseur est de l'ordre d'une centaine de fois, et est dû à plusieurs facteurs.
(Figure : vetopsy.fr d'après Kei Moritsugu)
1. il existe un effet de positionnement et de proximité entre la molécule et le site actif.
2. Un effet de catalyse acide-base intervient.
- Aux pH habituels de fonctionnement des enzymes, les concentrations en $\ce{H^+}$ et $\ce{0H^-}$ sont trop faibles pour que leur participation soit déterminante, mais, en revanche, plusieurs acides aminés des protéines enzymatiques possèdent des groupes fonctionnels ionisables, carboxyliques ou aminés.
- Leur dissociation dépend du pH à l'extérieur de la molécule, mais ils sont peu dissociés lorsqu'ils sont au sein de l'environnement hydrophobe, comme c'est le cas au niveau du site actif.
- Les acides aspartique et glutamique, la lysine et l'histidine peuvent ainsi intervenir, et l'action hydrolysante du lysozyme sur les liaisons glycosidiques est expliquée par la mise en jeu de ces résidus.
3. Un effet de contrainte conformationnelle est capable de jouer un rôle important dans le déclenchement de certaines réactions.
4. Un effet de catalyse covalente est fréquemment observé comme dans la formation d'une base de Schiff ($\ce{R2C=NR' avec R' ≠ H}$), entre un substrat à groupe carbonyle ($\ce{C=O}$) et un groupe amine primaire ($\ce{NH2}$) du site actif, comme lors de l'hydrolyse d'un peptide par une l'α-chymotrypsine.


