Transport des lipides
Lipoprotéines : HDL (lipoprotéines de haute densité)
Remodelage
des HDL par SR-B1, ABCG1 et l'ecto-F1-Atpase
- Biochimie
- Chimie organique
- Bioénergétique
- Composition de la matière vivante
- Composés organiques
- Protides
- Acides nucléiques
- Glucides
- Lipides
- Vue d'ensemble des lipides
- Acides gras
- Classification des lipides
- Cholestérol
- Glycérides
- Trafic non vésiculaire des lipides et LTP
- Digestion et absorption entérocytaire des lipides
- Lipoprotéines
- Gouttelettes lipidiques
- Coenzymes
- Hormones
- Composés inorganiques
- Composés organiques
- Transport membranaire
- Moteurs moléculaires
- Voies de signalisation

Le remodelage des HDL (lipoprotéines de haute densité) paut faire appel à SR-B1 et ABCG1 et l'ecto-F1-Atpase.
Le remodelage des HDL (lipoprotéines de haute densité), processus complexe et rapide, forme de nombreuses particules intermédiaires et peut s'effectuer par plusieurs voies différentes :
- (1a) pour les phospholipides (PL) et les triglycérides (TG) par l'action de la lipase hépatique (HL) et (1b) de la lipase endothéliale (EL),
- (2) pour les esters de cholestérol (CE) par CETP (Cholesteryl Ester (CE) Transfer Protein), suite à l'activité β de la LCAT (Lécithine-Cholestérol AcylTransférase),
- (3) pour les phospholipides (PL)par PLTP (Phospholipid transfer protein),
- (4) pour l'efflux de cholestérol par SR-BI (Scavenger Receptor-class B1) et ABCG1 (ATP-Binding Cassette transporter G1),
- (5) pour l'endocytose de la HDL entière (holo-HDL) par l'ecto-F1-ATPase.
4. Efflux de cholestérol par SR-B1 et ABCG1
Vue d'ensemble
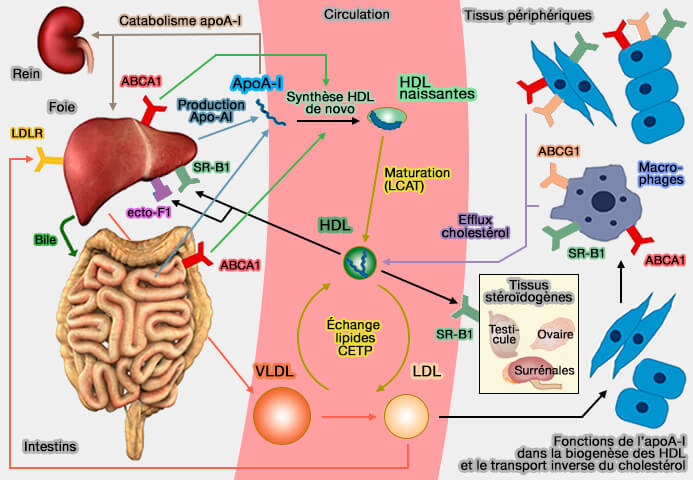
1. Le récepteur SR-B1 a deux rôles principaux dans le remodelage des HDL.
- SR-B1 facilite l'efflux de cholestérol des tissus périphériques, y compris les macrophages, vers les HDL matures, via une diffusion passive.
- Le foie absorbe sélectivement les lipides des HDL via SR-BI et transfère le cholestérol estérifié (CE) à la bile pour l'excrétion intestinale afin de compléter l'ensemble du processus RCT (SR-B1: A Unique Multifunctional Receptor for Cholesterol Influx and Efflux 2018).

Le récepteur SR-B1 et son rôle dans la voie RCT (transport inverse du cholestérol) sont étudiés dans des chapitres spéciaux.
(Figure : vetopsy.fr)
2. ABCG1 (ATP-Binding Cassette transporter G1), transporteur ABC de la famille G, joue un rôle majeur dans l'efflux de cholestérol et la voie RCT (transport inverse du cholestérol).

Le transporteur ABCG1 est étudié dans un chapitre spécial.
Endocytose des HDL

L'endocytose de HDL est toujours obscure à cause des problèmatiques expérimentales (Endocytosis of lipoproteins 2018).
- Le terme HDL décrit en fait un très large gamme de particules de lipoprotéines qui pourraient donc suivre différentes voies d'internalisation et de trafic.
- Les préparations utilisent une seule classe de lipoprotéines (par exemple HDL dans ce cas), excluant ainsi les interactions possibles et la concurrence pour les sites récepteurs, comme par exemple nt rapporté la compétition des HDL et LDL pour SR-BI des cellules endothéliales
- Les concentrations de HDL généralement utilisées in vitro pour étudier l'endocytose et l'association cellulaire sont bien inférieurs aux concentrations plasmatiques.
L'absorption des holoparticules d'HDL pourait être réalisée par plusieurs processus (HDL endocytosis and resecretion 2014).
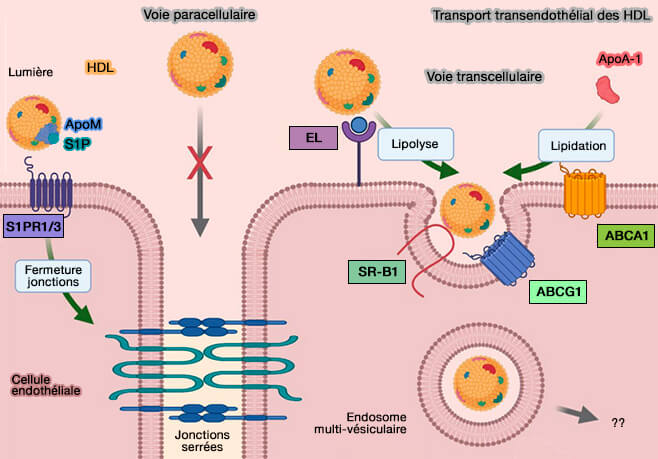
1. La transcytose des HDL est probablement effectuée par :
- un mécanisme impliquant EL (Endothélium Lipase), ABCG1 et SR-BI(Transendothelial transport of lipoproteins 2020),
- un mécanisme impliquant l'apoM/S1P (
transport endothélial lié à apoM/S1P).
(Figure : vetopsy.fr d'après Robert et coll)
2. L'endocytose ferait aussi intervenir CD36, un récepteur scavenger proche de SR-B1.
Les souris KO-CD36 ont montré une diminution de l'absorption des holo-HDL et du cholestérol par le foie (Scavenger receptor CD36 mediates uptake of high density lipoproteins in mice and by cultured cells 2011).
3. L'endocytose est aussi le fait de l'ecto-F1-ATPase.
4. Les HDL pourrait également pénétrer dans les cellules indépendament des récepteurs par d'autres mécanismes comme la pinocytose.
Remarque : les HDL intériorisés suivent la voie classique, i.e. endosomes précoce/endosomes tardif/lysosome, qui peut varier selon la HDL considérée.
- Certaines HDL sont recyclées rapidement via les endosomes de recyclage ou lentement via les endosomes tardifs.
- D'autres sont envoyées vers les lysosomes pour leur dégradation.
5. Remodelage des HDL par l'ecto-F1-ATPase
Vue d'ensemble de l'ecto-F1-ATPase
1. L'ATP synthase, ATPase à moteur rotatif, qui fait partie des F-ATPases (F1FO-ATPases), a été longtemps considérée comme localisée uniquement dans la membrane interne des mitochondries et est appelée MAS (Mitochondrial ATP synthase).
Puis on l'a trouvée aussi sur la face externe de la membrane plasmique (Systematic review of plasma-membrane ecto-ATP synthase: A new player in health and disease 2018) :
- les hépatocytes,
- des cellules endothéliales,
- des adipocytes,
- des kératinocytes,
- des cellules du système nerveux central (SNC).
(Figure : vetopsy.fr d'après Spikes et coll)
2. Lorsqu'elle est localisée à la membrane plasmique, elle est appelée ecto-F1-ATPase.
En effet, dans les conditions physiologiques, la surface cellulaire F1/FO-ATP synthase hydrolyse de l'ATP en ADP mais n'était pas capable de synthétiser l'ATP, à moins d'une forte acidose.
- L'oligomycine ou la forme recombinante IF1 (Inhibitory Factor) mutée (rIF1-H49K, histidine 49 changée en lysine), dont l'actvité inhibitrice n'est pas dépendante du pH, induit une diminution de la production de ADP extracellulaire(The potential role of mitochondrial ATP synthase inhibitory factor 1 (IF1) in coronary heart disease: a literature review 2017).
- L'ajout d'apoA-I sur les hépatocytes stimule fortement la production d'ADP extracellulaire.

L'ecto-F1-ATPase, couplé aux récepteurs purinergiques P2Y, sert de récepteur aux HDL pour moduler leurs fonctions métaboliques et vasculaires.
Structure de l'ecto-F1-ATPase
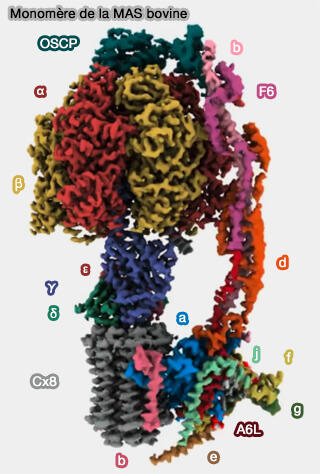
La structure de l'ecto-F1-ATPase mammalienne est complexe et est composée par 28 sous-unités de 17 polypeptides, assemblées en deux régions (CryoEM Reveals the Complexity and Diversity of ATP Synthases 2022).

Vous pouvez étudier la structure détaillée des MAS (Mitochondrial ATP synthase) dans : Structure of the dimeric ATP synthase from bovine mitochondria (2022), avec de nombreuses vidéos pour mieux expliquer la structure complexe (
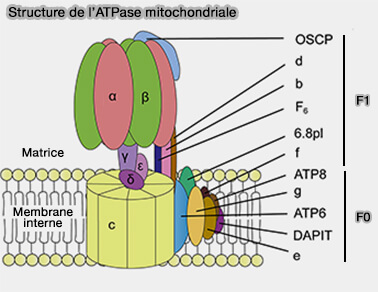
1. La région F0 est constituée de deux parties.
(Figure : vetopsy.fr d'après Wang et coll)
a. Le rotor, à l'intérieur duquel les ions H+ traversent la membrane, est constitué d'un anneau de huit sous-unités C, lié à une sous-unité ATP6.
b. La tige périphérique (PS ou Peripherical Stalk) qui s'étend aussi dans la région F1 comprend plusiuers sous-unités :
- OSCP (Oligomycin Sensitivity Conferring Protein,
- b, d et F6.
Les sous-unités e, f, g, ATP8 (ou A6L) et le 6.8pl (protéolipide) sont les sous-unités accessoires de la PS.
2. La région F1 est constituée aussi de deux parties.
a. La couronne catalytique abrite :
- trois sous-unités β, sites catalytiques,
- trois sous-unités α non catalytiques.
b. La tige centrale asymétrique, composée de sous-unités γ, δ et ε, est relié fortement au rotor, et coordonne le domaine membranaire interne Fo et le domaine catalytique F1.
3. Les sous-unités β catalytiques peuvent se présenter sous trois conformations différentes :
- un état ouvert sans liaison de nucléotide (E),
- un état relaché avec l'ADP et Pi liés (D),
- un état serré avec l'ATP synthétisée ou hydrolysée (T).

La conformation des sites catalytiques alterne les états E à T et D couplés avec la rotation de la tige centrale et du rotor
4. Les MAS monomères se dimérisent via l'interaction entre les sous-unités ATP6 et entre les 6,8pl, puis les dimères sont liés entre eux par une sous-unité DAPIT le long du bord des crêtes mitochondriales.
Fonctions de l'ecto-F1-ATPase
1. Ses fonctions sont les suivantes.
a. Sur les hépatocytes, l'ecto-F1-ATPase/P2Y13 contribue à l'endocytose des holoparticules HDL.
b. Sur les cellules endothéliales, l'ecto-F1-ATPase/P2Y12 est impliquée dans la protection endothéliale médiée par les HDL.
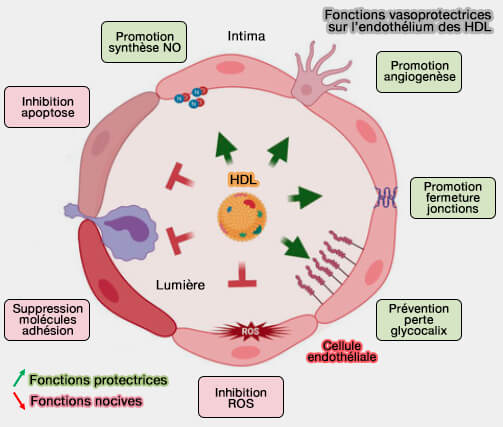
(Figure : vetopsy.fr d'après Feig et coll)
L'ATP synthase exprimée à la surface cellulaire, transloquée de la mitochondrie à la membrane cellulaire, est impliquée dans l'angiogenèse, la tumorigenèse et les métastases cancéreuses (Defueling the cancer: ATP synthase as an emerging target in cancer therapy 2021)
c. Sur les adipocytes, l'ecto-F1-ATPase/P2Y1 augmente la concentration intracellulaire des triglycérides (TG).
(Figure : vetopsy.fr d'après Maierean et coll)
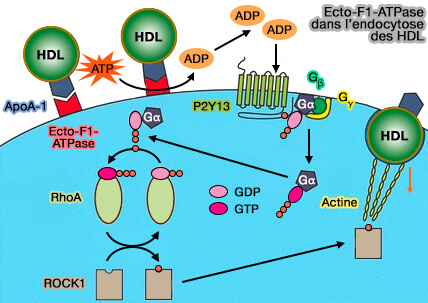
2. La liaison des remnants HDL, produits après l'action de la LPL (LipoProtéine Lipase), ou les apoA-I pauvre en lipides, lient leur apoA-I à la sous-unité β de l'ecto-F1-ATPase (Ecto-F1-ATPase/P2Y pathways in metabolic and vascular functions of high density lipoproteins 2015).

Elle favorise l'internalisation cellulaire de la particule HDL entière liées au SR-BI (Rôle de l’autophagie et du métabolisme nucléotidique extracellulaire dans la régulation de la voie ecto-F1-ATPase d’endocytose des HDL 2017).
Le mécanisme serait le suivant.
- a. La liaison de l’apoA-I libre ou associée aux HDL stimule l’activité ATPasique de l’ecto-F1-ATPase, augmentant la concentration d'ADP à partir de l'ATP.
- b. L’ADP généré active le récepteur purinergique P2Y13, un récepteur couplé aux protéines G, phosphorylant la molécule GDP trouvée sur la sous-unité alpha de la protéine G. Cette phosphorylation active la protéine G, la libérant de ses sous-unités bêta et gamma.
- c. La protéine G active ensuite RhoA par phosphorylation, ce qui rend la protéine G inactive où elle reviendra rejoindre ses sous-unités bêta et gamma sur la membrane plasmique interne.
- d. RhoA activé donnera alors un groupe phosphate à ROCK1, l'activant à son tour.
- e. ROCK1 entraîne alors un réarrangement du cytosquelette d’actine qui conduit à l’endocytose de la particule HDL via un récepteur de basse affinité dont l’identité reste encore inconnue.
Retour au remodelage des HDL
BiochimieChimie organiqueBioénergétiqueProtidesGlucidesLipidesAcides grasLipides vraisLipoïdesCholestérolGlycéridesPhospholipidesTrafic non vésiculaire et LTPDigestion et absorption entérocytaire des lipidesLipoprotéinesApolipoprotéinesTrafic des lipoprotéinesRécepteurs des lipoprotéinesGouttelettes lipidiques (LD)EnzymesCoenzymesVitaminesHormonesComposés inorganiquesTransport membranaireMoteurs moléculairesVoies de signalisation


