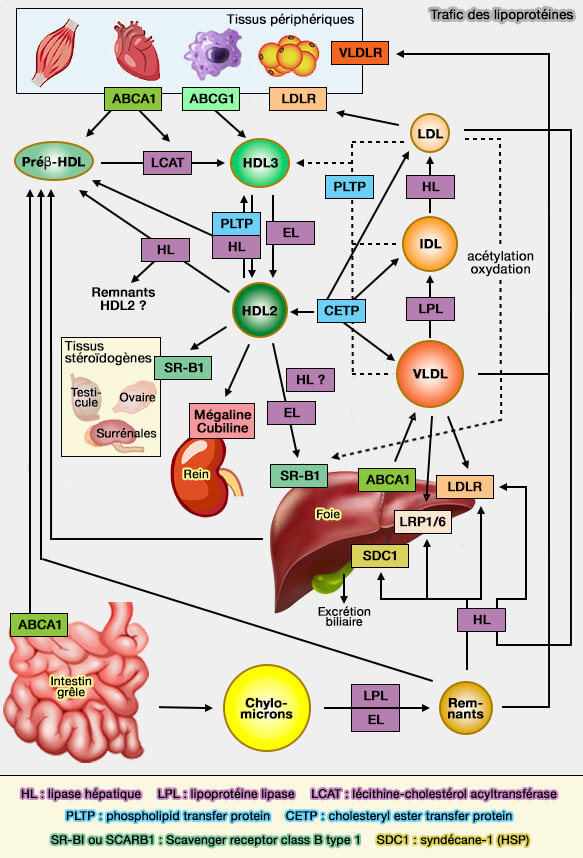
Transport des lipides
Lipoprotéines: HDL (lipoprotéines de haute densité)
Remodelage
des HDL par CETP : structure et interactions
- Biochimie
- Chimie organique
- Bioénergétique
- Composition de la matière vivante
- Composés organiques
- Protides
- Acides nucléiques
- Glucides
- Lipides
- Vue d'ensemble des lipides
- Acides gras
- Classification des lipides
- Cholestérol
- Glycérides
- Trafic non vésiculaire des lipides et LTP
- Digestion et absorption entérocytaire des lipides
- Lipoprotéines
- Gouttelettes lipidiques
- Coenzymes
- Hormones
- Composés inorganiques
- Composés organiques
- Transport membranaire
- Moteurs moléculaires
- Voies de signalisation

La CETP (Cholesteryl ester (CE) Transfer Protein) peut remodeler les HDL car elle peut transférer les esters de cholestérol en échange de triglycérides (TG) d'une HDL à une autre lipoprotéine à apoB et intervient de ca fait dans la la RCT (voie du transport inverse du cholestérol).
(Figure : vetopsy.fr)
Le remodelage des HDL (lipoprotéines de haute densité), processus complexe et rapide, forme de nombreuses particules intermédiaires et peut s'effectuer par plusieurs voies différentes :
- (1a) pour les phospholipides (PL) et les triglycérides (TG) par l'action de la lipase hépatique (HL) et (1b) de la lipase endothéliale (EL),
- (2) pour les esters de cholestérol (CE) par CETP (Cholesteryl Ester (CE) Transfer Protein), suite à l'activité β de la LCAT (Lécithine-Cholestérol AcylTransférase),
- (3) pour les phospholipides (PL)par PLTP (Phospholipid transfer protein),
- (4) pour l'efflux de cholestérol par SR-BI (Scavenger Receptor-class B1) et ABCG1 (ATP-Binding Cassette transporter G1),
- (5) pour l'endocytose de la HDL entière (holo-HDL) par l'ecto-F1-ATPase.
2. Remodelage par CETP (Cholesteryl ester (CE) Transfer Protein)
CETP (Cholesteryl ester (CE) Transfer Protein), appelée aussi plasma transfer protéine, comme son nom l'indique, est une protéine plasmatique qui peut transférer les esters de cholestérol, formés par les actions de LCAT (Lécithine-Cholestérol AcylTransférase), en échange de triglycérides (TG) d'une HDL à une autre lipoprotéine à apoB-, i.e. :
-
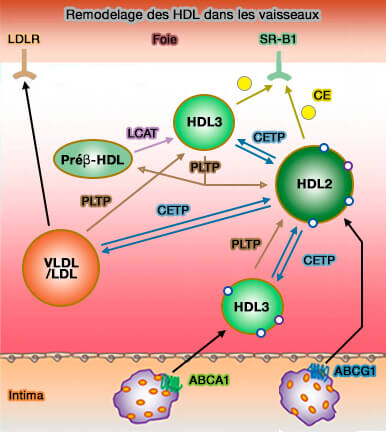
Remodelage des HDL dans les vaisseaux
(Figure : vetopsy.fr d'après Oulmet et coll) - IDL (lipoprotéines de densité intermédiaire),
- LDL (lipoprotéines de basse densité).
1. CETP intervient dans la voie RCT (transport inverse du cholestérol) ou voie de retour des lipides.
Il semblerait que (Cholesteryl ester transfer protein: The controversial relation to atherosclerosis and emerging new biological roles 2011) :
- 66% du cholestérol retourne au foie par CETP (Cholesteryl Ester Transfer Protein A Novel Target for Raising HDL and Inhibiting Atherosclerosis 2003),
- 33% par SR-B1 (
voie directe du RCT).
2. CETP appartient à la famille des LTP/LBP, i.e. Lipid TransferProtein/Lipopolysaccharide Binding Protein, de forme tubulaire (TULIP) à laquelle appartient, entre autres, PLTP (Phospholipid transfer protein), mais aussi les E-Syt/Tcb (Extended SYynaptoTagmines/Tricalbine)) ou le complexe ERMES de la levure.
Structure de CETP
CETP, glycoprotéine plasmatique de 476 résidus, est principalement exprimée chez l'homme dans le foie, l'intestin grêle, le tissu adipeux et la rate.
La transcription du gène CETP, sur le chromosome 16q21, principalement produit par le foie chez les mammifères, est contrôlé plusieurs facteurs intrinsèques et extrinsèques, i.e. :
- l'augmentation des niveaux de cholestérol par LXR (Liver X Receptor),
- l'augmentation des niveaux d'acides biliaires par FXR ou FaRnesoid X receptor(
FXR et acides biliaires).

Vous pouvez lire pour une revue et une bibliographie récente : Structure-based mechanism and inhibition of cholesteryl ester transfer protein (2023).
1. CETP possède (Crystal structure of cholesteryl ester transfer protein reveals a long tunnel and four bound lipid molecules 2008) :
-
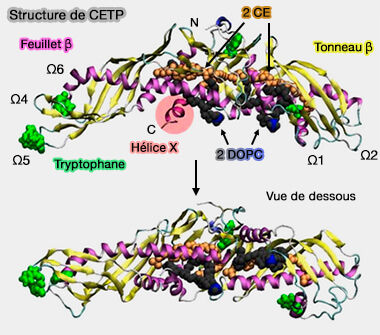
Structure de CETP
(Figure : vetopsy.fr d'après Koivuniemi et coll) - un feuillet β central,
- un tonneau bêta dans le domaine C-terminal qui comprend une extension appelée l'hélice X, hélice amphipathique (Glu465-Ser476),
- un tunnel central continu d'environ 60 Å de long hautement hydrophobe, cas unique dans les LTP/LBP.
On peut aussi définir des régions Ω variables : Ω1, Ω2, Ω3 (380-400), Ω4 (40-50), Ω5 (90-110), Ω6 (150-170), Ω7 (230-260).
Remarque : d'autres méthodes ont confirmé cette structure (An Algorithm for Enhancing the Image Contrast of Electron Tomography 2018 et Structural basis of transfer between lipoproteins by cholesteryl ester transfer protein 2012).
2. Deux pores proches du domaine central du feuillet β, bouchées par deux molécules de phospholipides amphiphiles, pourraient être les portes entre lesquelles la cavité centrale interagirait avec l'environnement aqueux ou les lipoprotéines, favorisant ainsi le mécanisme de navette.
- Le tunnel CETP central peut accueillir deux molécules de cholestérol estérifié (CE), une molécule de CE et une molécule de triglycérides (TG) ou deux molécules TG (Lipid Exchange Mechanism of the Cholesteryl Ester Transfer Protein Clarified by Atomistic and Coarse-grained Simulations 2012 et Structural basis of transfer between lipoproteins by cholesteryl ester transfer protein 2012).
- Les mutations de résidus dans le tunnel central modifie l'architecture du tunnel et réduit l'activité de transfert du CETP.
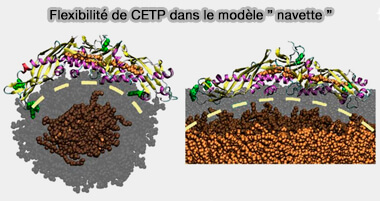
(Figure : vetopsy.fr d'après Koivuniemi et coll)
Lorsque les CE sont transportés à travers la CEPT, le tunnel s'ouvre avec un changement conformationnel concerté de l'hélice X flexible ou d'un volet mobile, ce qui offre un espace suffisant pour le transport des CE, ce qui définit le modèle dit " navette ".
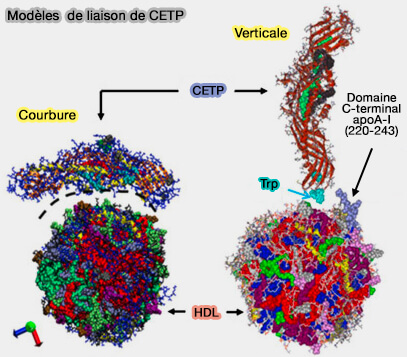
3. La CETP est une molécule très flexible qui subit un mouvement de torsion lorsqu'elle se lie aux lipides (
Complexe binaire CETP-HDL
L'étude cristalline et les simulations MD (Molecular Dynamic ou dynamique moléculaire) de CETP montre une conformation dans laquelle la surface concave de CETP s'aligne avec la surface convexe de la HDL (Crystal structure of cholesteryl ester transfer protein reveals a long tunnel and four bound lipid molecules 2008 et Lipid Exchange Mechanism of the Cholesteryl Ester Transfer Protein Clarified by Atomistic and Coarse-grained Simulations 2012).
1. Les études suivantes ont montré que les particules sphériques de HDL contenaient une seule caractéristique saillante de surface pour former une structure en forme de sucette (Structural basis of transfer between lipoproteins by cholesteryl ester transfer protein 2012 et HDL surface lipids mediate CETP binding as revealed by electron microscopy and molecular dynamics simulation 2015 et Cholesteryl ester transfer between lipoproteins does not require a ternary tunnel complex with CETP 2016).
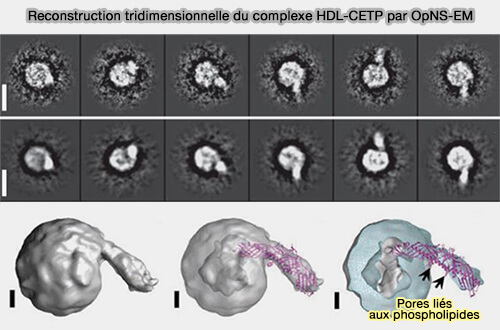
(Figure : vetopsy.fr d'après Zhang et coll)
2. La protrusion indiquait l'extrémité distale de la CETP ( 48 ± 10 Å), i.e. son domaine N-terminal hautement hydrophobe, insérée dans la surface HDL.
(Figure : vetopsy.fr d'après Shrestra et coll)
Cet arrimage est sous-tendue par une interaction protéine-lipide, confirmée par l'observation qu'une structure sucette est également observée dans les incubations de CETP avec des liposomes sans protéines (HDL surface lipids mediate CETP binding as revealed by electron microscopy and molecular dynamics simulation 2015)
- Les régions flexibles de la CETP, i.e. le volet 5 (Ω5 Ser90-Asp110) et le volet 6 (Ω6 Leu150-Phe170) à l'extrémité du domaine N-terminal de la CETP jouent un rôle d'ancrage important
- Lors de la pénétration, la distance entre Trp106 dans le volet 5 et Trp162 dans le volet 6 a été augmentée, suggérant que les Ω5 et Ω6 sont écartés, ce qui donne lieu à l'ouverture du tunnel CETP (Atomistic MD simulation reveals the mechanism by which CETP penetrates into HDL enabling lipid transfer from HDL to CETP 2015).
3. Toutefois,
comme on ne sait toujours pas si les apolipoprotéines de surface HDL, en particulier l'apoA-I, sont impliquées dans l'interaction avec la CETP (
- CETP pourrait interagir directement avec le domaine N-terminal de l'apoA-I des HDL (Cholesteryl ester transfer protein and its inhibitors 2018).
- L'augmentation de la quantité d'apoA-II, qui déplace l'apoA-I des particules HDL, diminuerait l'activité de la CETP.
Complexe binaire CETP-LDL/VLDL
1. Les interactions entre CETP et lipoprotéines à apoB sont les suivantes (An Algorithm for Enhancing the Image Contrast of Electron Tomography 2018 et Structural basis of transfer between lipoproteins by cholesteryl ester transfer protein 2012).
- Un seul CETP dépassant de la surface des LDL (lipoprotéines de basse densité) sous la forme d'un complexe binaire en forme de sucette.
- Aucune molécule de CETP reliant deux HDL, deux LDL ou deux VLDL (lipoprotéines de très basse densité) n'a été observée.
- Plusieurs molécules de CETP peuvent être attachées occasionnellement à la surface des particules de VLDL, ce qui peut être dû à une plus grande variété d'apolipoprotéines de VLDL.
- L'anticorps du tonneau bêta C-terminal, H300, a bloqué l'interaction CETP-LDL mais pas l'interaction CETP-HDL.
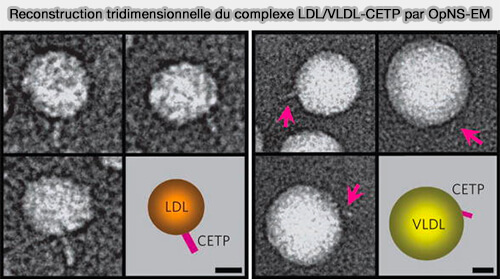
(Figure : vetopsy.fr d'après Zhang et coll)
2. Il semblerait que :
- l'extrémité distale hydrophobe du domaine N-terminal de la CETP interagit préférentiellement avec les lipides de surface des HDL.
- L'extrémité distale du domaine C-terminal s'insère dans les surfaces LDL et VLDL via une interaction protéine-protéine.
Cette spécificité pourrait être due à la taille plus grande et la forme polyédrique des lipoprotéines apoB, qui se caractérise par une moindre courbure des lipides de surface et une hydrophobicité plus faible, ce qui réduirait l'énergie de liaison à l'extrémité N-terminale hydrophobe de la CETP (Single-molecule 3D imaging of human plasma intermediate-density lipoproteins reveals a polyhedral structure 2019).
Modèles de l'action de CETP
BiochimieChimie organiqueBioénergétiqueProtidesGlucidesLipidesAcides grasLipides vraisLipoïdesCholestérolGlycéridesPhospholipidesTrafic non vésiculaire et LTPDigestion et absorption entérocytaire des lipidesLipoprotéinesApolipoprotéinesTrafic des lipoprotéinesRécepteurs des lipoprotéinesGouttelettes lipidiques (LD)EnzymesCoenzymesVitaminesHormonesComposés inorganiquesTransport membranaireMoteurs moléculairesVoies de signalisation


