Transport des lipides
Lipoprotéines : HDL (lipoprotéines de haute densité)
Remodelage des HDL par la lipase endothéliale (EL)
- Biochimie
- Chimie organique
- Bioénergétique
- Composition de la matière vivante
- Composés organiques
- Protides
- Acides nucléiques
- Glucides
- Lipides
- Vue d'ensemble des lipides
- Acides gras
- Classification des lipides
- Cholestérol
- Glycérides
- Trafic non vésiculaire des lipides et LTP
- Digestion et absorption entérocytaire des lipides
- Lipoprotéines
- Gouttelettes lipidiques
- Coenzymes
- Hormones
- Composés inorganiques
- Composés organiques
- Transport membranaire
- Moteurs moléculaires
- Voies de signalisation

La lipase endothéliale (EL) joue un rôle important dans le remodelage des HDL.
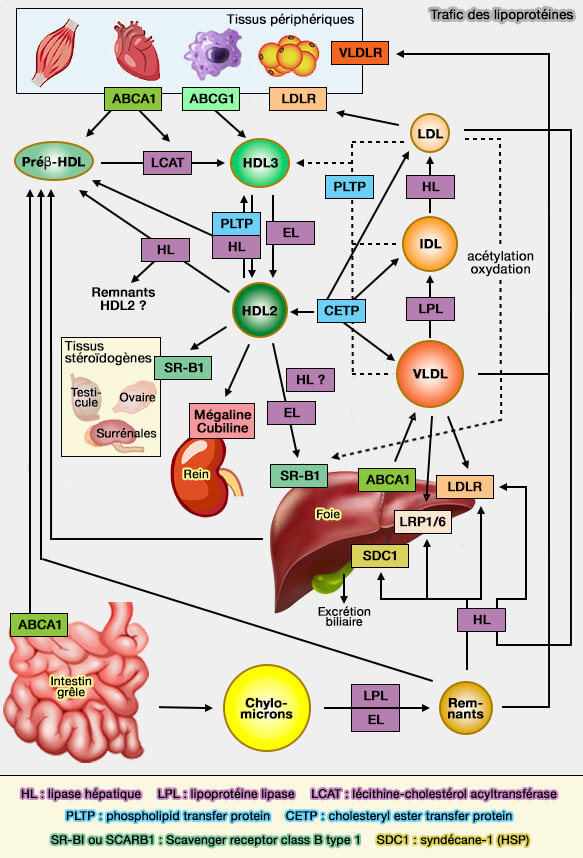
(Figure : vetopsy.fr)
Le remodelage des HDL (lipoprotéines de haute densité), processus complexe et rapide, forme de nombreuses particules intermédiaires et peut s'effectuer par plusieurs voies différentes :
- (1a) pour les phospholipides (PL) et les triglycérides (TG) par l'action de la lipase hépatique (HL) et (1b) de la lipase endothéliale (EL),
- (2) pour les esters de cholestérol (CE) par CETP (Cholesteryl Ester (CE) Transfer Protein), suite à l'activité β de la LCAT (Lécithine-Cholestérol AcylTransférase),
- (3) pour les phospholipides (PL)par PLTP (Phospholipid transfer protein),
- (4) pour l'efflux de cholestérol par SR-BI (Scavenger Receptor-class B1) et ABCG1 (ATP-Binding Cassette transporter G1),
- (5) pour l'endocytose de la HDL entière (holo-HDL) par l'ecto-F1-ATPase.
Remodelage par la lipase endothéliale (EL ou LIPG)
La lipase endothéliale (LIPG ou LIPaseG, type endothélial, ou EL) et la lipase hétatique (HL) sont deux lipases plasmatiques qui jouent un rôle important dans le remodelage des HDL (lipoprotéines de haute densité) en hydrolysent :
- les phospholipides (PL) principalement,
- les triglycérides (TG) dans une moindre mesure.
1. La lipase endothéliale (EL) est un membre dérivé de l'endothélium de la famille des gènes LPL (LipoProtéine Lipase) sur la base de sa séquence primaire et est structurellement similaire à la LPL. (The Role of Endothelial Lipase in Lipid Metabolism, Inflammation, and Cancer 2018).
2. EL est synthétisée et sécrétée par les cellules endothéliales dans les tissus à taux métabolique et vascularisation élevés, i.e. foie, poumons, reins, glande thyroïde, gonades et placenta (Genetic and Structure-Function Studies of Missense Mutations in Human Endothelial Lipase 2013).
EL est soit lié aux HSPG (Heparan Sulfate ProteoGlycan), recouvrant la membrane cellulaire luminale des cellules endothéliales, soit libre dans le plasma.

Contrairement aux fonctions primaires de lipase de LPL (LipoProtéine Lipase) et HL (Hepatic lipase), EL fonctionne principalement comme une phospholipase, mais maintient de faibles niveaux d'activité de triglycéride lipase (Characterization of the lipolytic activity of endothelial lipase 2002).
Structure de EL
Sa structure tertiaire n'a pas encore été révélée (Cloning of a Unique Lipase from Endothelial Cells Extends the Lipase Gene Family 1999 et A novel endothelial-derived lipase that modulates HDL metabolism 1999).
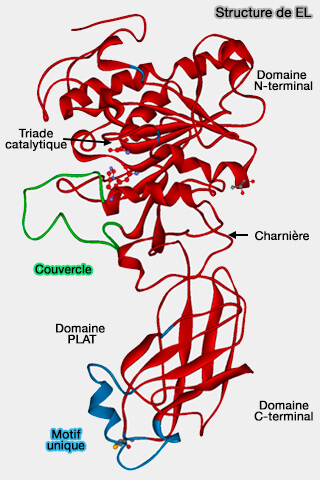
(Figure : vetopsy.fr d'après Razzaghi et coll)
Toutefois, elle montre une identité de 44 % avec la LPL (LipoProtéine Lipase), 41 % avec HL (Hepatic lipase) et 27 % avec la lipase pancréatique (PL), i.e. (Comparative Analyses of Lipoprotein Lipase, Hepatic Lipase, and Endothelial Lipase, and Their Binding Properties with Known Inhibitors 2013).
1. Le domaine N-terminal (1-341) contient :
- une région catalytique similaire, avec une conservation de la triade catalytique, i.e. Ser169, Asp193 et His274, nécessaire à l'hydrolyse des lipides
- un couvercle recouvrant le site catalytique, dans la EL, 252-272,
2. Le domaine N-terminal comprend un domaine PLAT, ici 347-482 de liaison au substrat (
La principale différence entre EL et les autres membres de la famille des lipases réside dans le domaine PLAT dans lequel une boucle d'acides aminés de 23 résidus (418- GASQSWYNLWKEFRSYLSQPRNPG-441) est unique dans cette classe (Substrate specificity of lipoprotein lipase and endothelial lipase: studies of lid chimeras 2006).
3. Dix résidus de cystéine impliqués dans la formation de ponts disulfure, ainsi que deux parties hydrophobes aux deux extrémités de la triade catalytique pourraient être nécessaires pour la liaison au substrat.
4. En outre, EL possède cinq sites de N-glycosylation, i.e. avec la séquence consensus Asn-X-(Ser/Thr), pour l'interaction avec les protéoglycanes d'héparine/héparane sulfate (HS) à la surface de la cellule (Effects of Nonlipolytic Ligand Function of Endothelial Lipase on High Density Lipoprotein Metabolism in Vivo 2003).
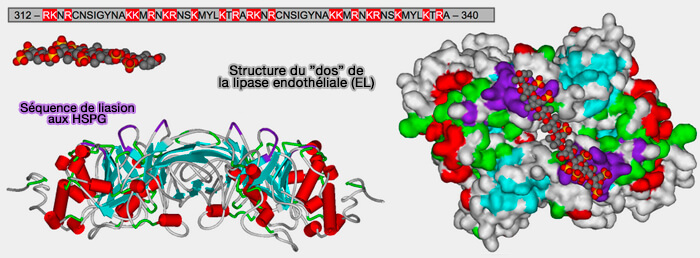
(Figure : vetopsy.fr d'après Razzaghi et coll)
5. Les deux domaines N- et C-terminaux d'EL sont reliés par une boucle charnière (338–347), donnant à la molécule la flexibilité de se lier aux HDL (lipoprotéines de haute densité) sous forme d'homodimère (Identification of the Active Form of Endothelial Lipase, a Homodimer in a Head-to-Tail Conformation 2009).
- La région charnière contient un site de clivage protéolytique (RNKR) pour la proprotéine convertase, un mécanisme de régulation de la fonction EL (Proprotein Covertases Are Responsible for Proteolysis and Inactivation of Endothelial Lipase 2005).
-
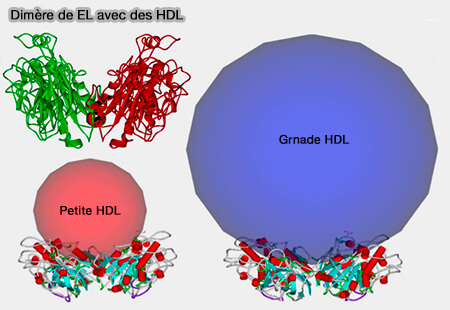
Dimère de lipase endothéliale (EL) avec des HDL
(Figure : vetopsy.fr d'après Razzaghi et coll)
Fonctions de EL dans
le métabolisme des
lipoprotéines
Fonction enzymatique
Dans les HDL
La fonction principale de EL est de favoriser le catabolisme des HDL (lipoprotéines de haute densité).
1. Chez la souris, la surexpression de EL :
- réduit les HDL-C, i.e. HDL à cholestérol associées à une protection contre les maladies cardiovasculaires athérosclérotiques,
- favorise le catabolisme des HDL (Endothelial lipase is a major determinant of HDL level 2003).
2. Chez l'homme, des pertes de fonctions dans le gène LIPG montrent des niveaux nettement élevés de HDL-C et une diminution du catabolisme des HDL (Loss-of-function variants in endothelial lipase are a cause of elevated HDL cholesterol in humans 2009).
Dans les autres lipoprotéines
1. EL a une activité phospholipase sur les LDL (lipoprotéines de basse densité), aussi bien in vitro qu'in vivo, ce qui favorise leur catabolisme (Endothelial Lipase Promotes the Catabolism of ApoB-Containing Lipoproteins 2003 et Glycosylation of endothelial lipase at asparagine-116 reduces activity and the hydrolysis of native lipoproteins in vitro and in vivo 2007).
Or, EL, comme LPL (LipoProtéine Lipase), est inhibé par ANGPTL3 et des études récentes (
L'augmentation de l'activité EL contribuerait à la réduction des taux de LDL-C dans le cadre de l'inhibition d'ANGPTL3 (Angiopoietin-like protein 3 governs LDL-cholesterol levels through endothelial lipase-dependent VLDL clearance 2020).
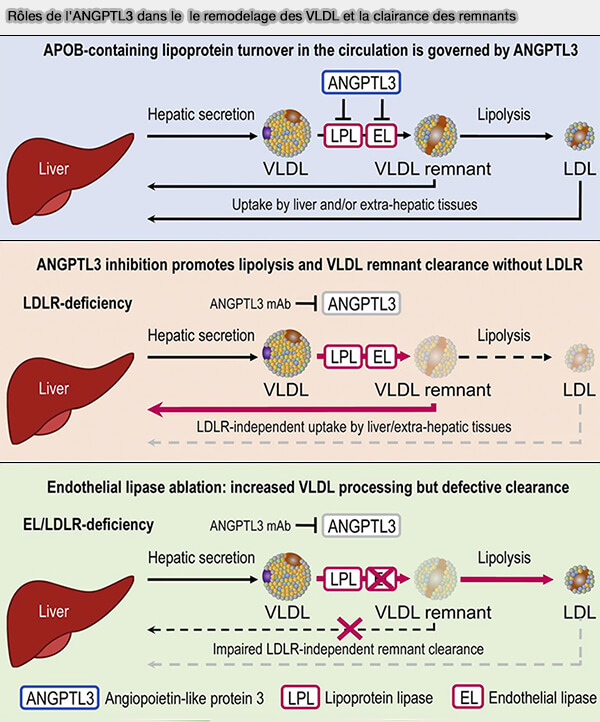
(Figure : vetopsy.fr d'après Adam et coll)
2. La suppression de la LPL (LipoProtéine Lipase) spécifique du tissu adipeux chez la souris provoque une profonde régulation à la hausse de l'expression de EL et de l'activité de la phospholipase dans ces tissus, augmentant ainsi l'absorption d'acides gras médiée par les TRL dans le cadre de déficit en LPL (Endothelial lipase provides an alternative pathway for FFA uptake in lipoprotein lipase–deficient mouse adipose tissue 2005).
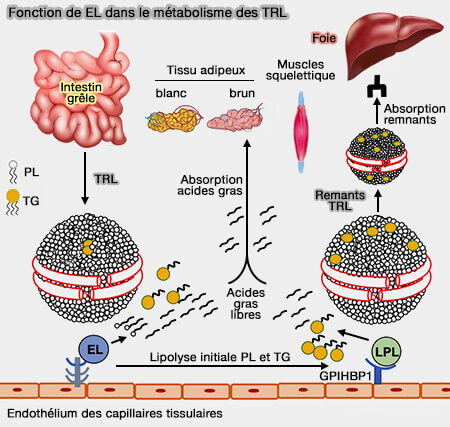
(Figure : vetopsy.fr d'après Khetarpal et coll)
Étant donné que EL est exprimé dans tout l'endothélium vasculaire où se trouve LPL, EL pourrait collaborer avec LPL et contribuer à la lipolyse des TRL in vivo (Endothelial lipase mediates efficient lipolysis of triglyceride-rich lipoproteins 2021).
a. Chez les souris normales, la lipolyse des phospholipides sur les TRL (lipoprotéines riches en triglycérides) en état postprandial ou riche en graisses permet une lipolyse des triglycérides (TG) synergique et efficace par la LPL.
Ce processus favorise l'absorption des acides gras libres, y compris les acides gras polyinsaturés (AGPI ou PUFA) à longue chaîne et des remnants par le foie.
b. Chez les souris déficientes en EL, la lipolyse des phospholipides (PL) sur l'enveloppe externe des TRL est altérée, ce qui entraîne un accès moins efficace de la LPL aux TG des TRL, réduit leur lipolyse, et donc le remodelage des TRL en remnants, réduisant ainsi l'absorption des remnants par le foie.
De plus, le manque de capacité d'EL à catalyser la lipolyse des phospholipides contenant les AGPI, i.e. ses substrats préféré, entraîne une diminution de l'absorption d'AGPI par le foie.
Fonction non enzymatique : internalisation des lipoprotéines
Les cinq sites de N-glycosylation permettraient à EL de servir de protéines de liaison entre les lipoprotéines et les HSPG (Heparan Sulfate ProteoGlycan), à la surface des cellules (Endogenously Produced Endothelial Lipase Enhances Binding and Cellular Processing of Plasma Lipoproteins via Heparan Sulfate Proteoglycan-mediated Pathway 2003).
1. EL faciliterait ainsi l'internalisation dans la cellule par endocytose des HDL (lipoprotéines de haute densité), LDL (lipoprotéines de basse densité) et VLDL (lipoprotéines de très basse densité) conduisant à leur catabolisme pour fournir à la cellule les précurseurs lipidiques nécessaires à la biosynthèse des lipides.
- Alors que la LPL (LipoProtéine Lipase) favorise la liaison et l'absorption de toutes les espèces de lipoprotéines, EL intériorise plus efficacement les LDL et les VLDL que les HDL.
- Grâce à ce mécanisme, les LDL et les VLDL fournissent des précurseurs lipidiques à la cellule.
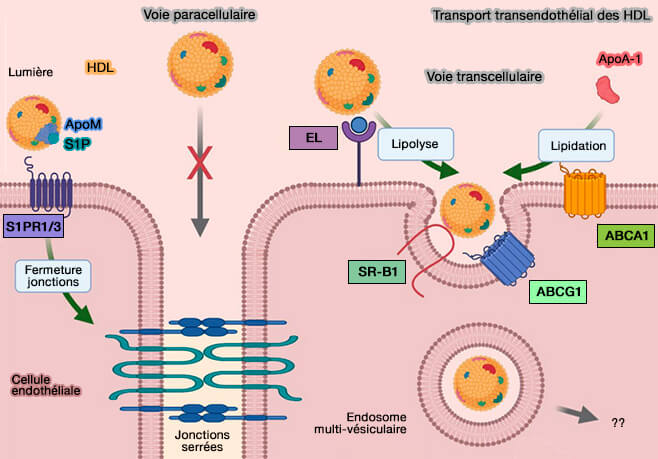
(Figure : vetopsy.fr d'après Robert et coll)
2. Toutefois, la grande partie des HDL sont liées et libérées sans internalisation, car l'endocytose par les HSPG dépend de leur regroupement par de grands ligands.
Les surfaces plus petites des HDL seraient donc moins efficace que les lipoprotéines plus grandes.
Autres fonctions de EL
EL, à part son rôle dans le métabolisme des lipoprotéines, par son activité de phospholipase, est un composant d'autres processus biologiques :
- l'expression des cytokines et donc l'inflammation (LIPG: an inflammation and cancer modulator 2021),
- la composition des lipides dans les cellules,
- les cancers (FoxA and LIPG endothelial lipase control the uptake of extracellular lipids for breast cancer growth 2016 et The Role of Endothelial Lipase in Lipid Metabolism, Inflammation, and Cancer 2018).

Vous trouverez des études détailléees dans les articles ci-dessus.
Remodelage par CETP (Cholesteryl Ester (CE) Transfer Protein)
BiochimieChimie organiqueBioénergétiqueProtidesGlucidesLipidesAcides grasLipides vraisLipoïdesCholestérolGlycéridesPhospholipidesTrafic non vésiculaire et LTPDigestion et absorption entérocytaire des lipidesLipoprotéinesApolipoprotéinesTrafic des lipoprotéinesRécepteurs des lipoprotéinesGouttelettes lipidiques (LD)EnzymesCoenzymesVitaminesHormonesComposés inorganiquesTransport membranaireMoteurs moléculairesVoies de signalisation


