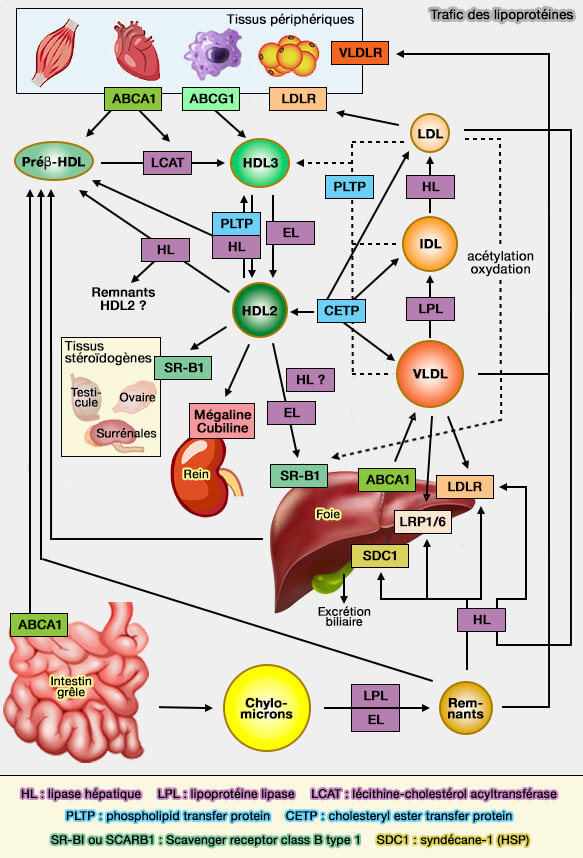
Transport des lipides
Lipoprotéines : HDL (lipoprotéines de haute densité)
Biogenèse
des HDL : formation des α-HDL
- Biochimie
- Chimie organique
- Bioénergétique
- Composition de la matière vivante
- Composés organiques
- Protides
- Acides nucléiques
- Glucides
- Lipides
- Vue d'ensemble des lipides
- Acides gras
- Classification des lipides
- Cholestérol
- Glycérides
- Trafic non vésiculaire des lipides et LTP
- Digestion et absorption entérocytaire des lipides
- Lipoprotéines
- Gouttelettes lipidiques
- Coenzymes
- Hormones
- Composés inorganiques
- Composés organiques
- Transport membranaire
- Moteurs moléculaires
- Voies de signalisation

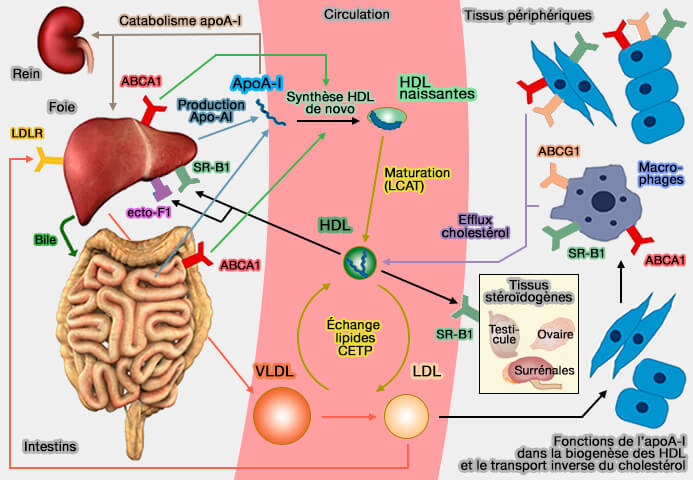
Les préβ-HDL discoïdales, dépourvues de cœur lipidique, se transforment en α-HDL sphériques, contenant un noyau hydrophobe sous l'action de la LCAT dont le principal activateur est l'apoA-I.
(Figure : vetopsy.fr)
Le processus de la formation des HDL (lipoprotéines de haute densité), qui comprend plus de neuf modèles différents (Molecular mechanisms for ABCA1-mediated cholesterol efflux 2022), passe par plusieurs étapes :
- la formation des particules préβ-HDL qui comprend, selon les auteurs, les apoA-I peu lipidées et les HDL discoïdales,
- la formation des particules α-HDL sphériques.
Les mutations de l'apoA-I., ABCA1 et LCAT empêchent la formation de HDL contenant de l'apoA-I.
(Figure : vetopsy.fr)
Formation des α-HDL sphériques
LCAT dont le principal activateur est l'apoA-I. va transformer les préβ-HDL discoïdales, dépourvues de cœur lipidique, en α-HDL sphériques, contenant un noyau hydrophobe.
LCAT
Vue d'ensemble
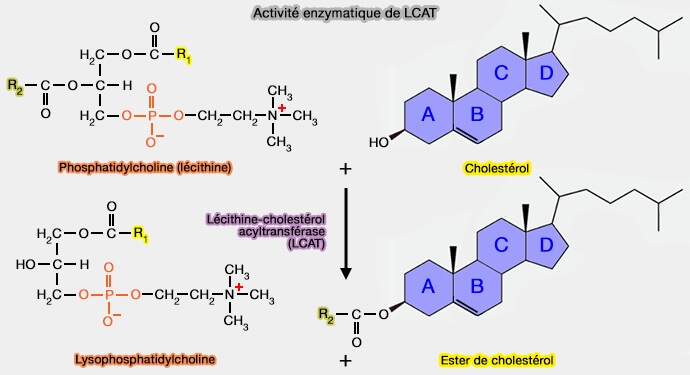
L'estérification du cholestérol libre (FC) par LCAT (Lécithine-Cholestérol AcylTransférase) convertit les préβ-HDL en particules α-HDL sphériques (Lecithin:cholesterol acyltransferase: old friend or foe in atherosclerosis? 2012).

LCAT est la seule enzyme capable d'estérifier le cholestérol sur les lipoprotéines plasmatiques.
1. La LCAT (Lécithine-Cholestérol AcylTransférase) plasmatique, (EC 2.3.1.43) est une protéine longue de 416 acides aminés, synthétisée et sécrétée principalement par les hépatocytes et, dans une bien moindre mesure, par les astrocytes et les cellules testiculaires.
- LCAT possède quatre sites de N-glycosylation (Asn20, 84, 272 et 384) et deux sites de O-glycosylation (Thr407 et Ser409).
- La teneur en glucides est d'environ 25% de sa masse totale.
(Figure : vetopsy.fr)
La LCAT interagit avec les HDL discoïdales et sphériques et catalyse le transfert du groupe acyle ($\ce{R-C(=O)-}$ en position 2 de la phosphatidylchoine (PC) au résidu 3-hydroxyle libre du cholestérol pour former l'ester de cholestérol (Lecithin:cholesterol acyltransferase: old friend or foe in atherosclerosis? 2012).
$\ce{Phosphatidylcholine + cholestérol}$ $\leftrightharpoons$ $\ce{Lysophosphatidylcholine + cholestérol-ester}$
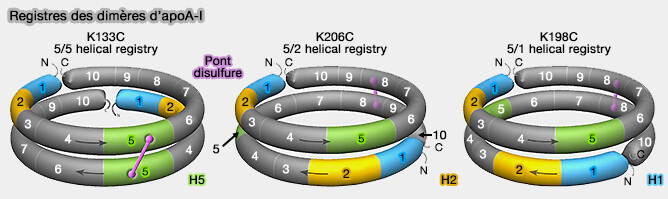
2. LCAT est activée principalement par l'apoA-I mais peut également être activé par l'apoA-IV, l'apoC-I et l'apoE (Dynamics of lecithin:cholesterol acyltransferase activation by apolipoprotein A-I 2009).
- Les résidus R130 et K133 jouent un rôle important dans la formation d'un tunnel de présentation amphipathique situé entre les hélices 5-5 dans le modèle à double ceinture.
- Un tel tunnel pourrait permettre la migration des chaînes acyles hydrophobes des phospholipides et du cholestérol amphipathique non estérifié de la bicouche vers le site actif de LCAT qui contient des sites pour l'activité phospholipase et l'activité d'estérification.
(Figure : vetopsy.fr d'après Cooke et coll)
Activité de LCAT
1. Deux types d'activité LCAT peuvent être distinguées (Lecithin Cholesterol Acyltransferase: An Anti- or Pro-atherogenic Factor? 2011).
- L'activité α décrit l'activité enzymatique de la LCAT vis-à-vis du cholestérol lié aux lipoprotéines contenant l'apoA-I comme les HDL (75%), i.e. les esters de cholestérol étant transmis ensuite aux lipoprotéines à apoB par CETP (Cholesteryl Ester Transfer Protein), i.e. chylomicrons, VLDL, IDL et LDL.
- L'activité β constitue l'activité enzymatique de la LCAT vis-à-vis du cholestérol libre lié sur les lipoprotéines contenant l'apoB (25%).
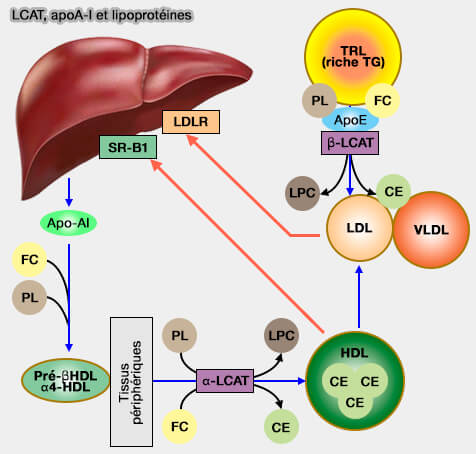
(Figure : vetopsy.fr d'après Cooke et coll)
2. L'activité de la LCAT sur les particules HDL naissantes a plusieurs conséquences métaboliques (Is Low-Density Lipoprotein Cholesterol the Key to Interpret the Role of Lecithin:Cholesterol Acyltransferase in Atherosclerosis? 2018).
a. La conversion du cholestérol libre (FC) en cholestérol estérifié (CE) plus hydrophobe favorise la migration des esters de cholestérol vers le cœur des particules HDL sphériques, générant ainsi un gradient de cholestérol non estérifié entre la surface des lipoprotéines et la membrane cellulaire périphérique.
b. De plus, la maturation du HDL dans les particules enrichies en esters de cholestérol facilite leur remodelage et leur catabolisme en favorisant l'interaction avec :
- les protéines circulantes, comme CETP (Cholesteryl Ester (CE) Transfer Protein) par exemple, mais aussi bien d'autres,
- les récepteurs des cellules hépatiques comme SR-B1.
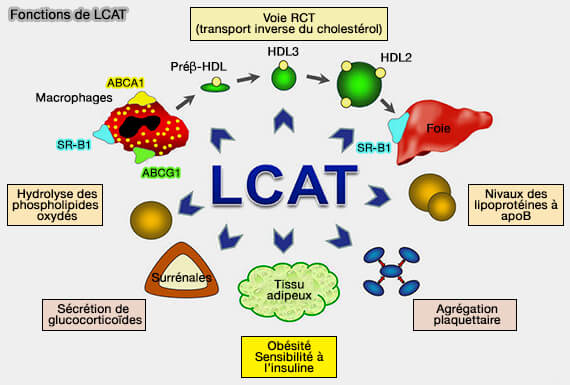
(Figure : vetopsy.fr d'après Kunnen et Van Eck)
PLTP (Phospholipid transfer protein)
PLTP (Phospholipid transfer protein), comme son nom l'indique, est une protéine plasmatique qui peut transférer principalement les phospholipides (PL).
PLTP permet, entre autres, d'enrichir les pré-β-HDL pour siuivre l'augmentation de volume de ces particules (
-

PLTP est étudié dans un chapitre spécial.
Rôles de apo-AII
L'apoA-II, majoritairement exprimé dans le foie, deuxième apolipoprotéine la plus abondante après l'apoA-I, représente environ 20 % des apolipoprotéines présentes dans les HDL (lipoprotéines de haute densité).
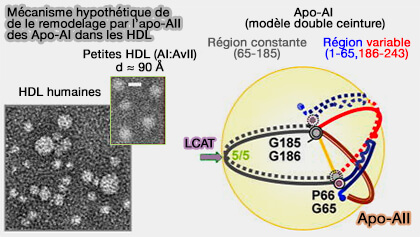
(Figure : vetopsy.fr d'après Gao et coll)
1. La liaison de l'apoA-II à ces particules est facilitée par :
- une plus grande affinité d'apoA-II pour les lipides,
- la teneur accrue en lipides et la présence d'esters de cholestérol (CE) dans le noyau.
2. Cette affinité plus forte de l'apo-AII pour les lipides par rapport à l'apoA-I semble avoir un impact significatif :
- sur les propriétés des HDL,
- sur la conformation de l'apoA-I, jouant un rôle clé dans la stabilisation de la structure des HDL.

L'apoA-II est étudié dans un chapitre spécial.
2. En ce qui concerne la teneur en apoA-I et apoA-II, les HDL peuvent être classées en deux sous-populations qui diffèrent par leur stabilité structurelle et leur devenir métabolique.
- Les LpAI:AII contenant apoA-I et apoA-II sont impliquées dans le transport des lipides.
- les LpAI contenant uniquement de l'apoA-I interviennent aussi dans bien d'autres processus (
autres fonctions de l'apoA-I).
Remodelage des HDL
BiochimieChimie organiqueBioénergétiqueProtidesGlucidesLipidesAcides grasPhospholipidesPhosphoinositidesCholestérolAcides biliairesGlycéridesDigestion et absorption entérocytaire des lipidesLipoprotéinesApolipoprotéinesTrafic des lipoprotéinesRécepteurs des lipoprotéinesGouttelettes lipidiques (LD)EnzymesCoenzymesVitaminesHormonesComposés inorganiquesTransport membranaireMoteurs moléculairesVoies de signalisation


