Enzymes
Groupe des hydrolases (EC 3)
GTPases : vue d'ensemble
- Biochimie
- Chimie organique
- Bioénergétique
- Composition de la matière vivante
- Composés organiques
- Protides
- Acides nucléiques
- Glucides
- Lipides
- Enzymes
- Classification des enzymes
- Oxydoréductases (EC 1)
- Transférases (EC 2)
- Hydrolases (EC 3)
- Lyases ou synthases (EC4)
- Isomérases (EC5)
- Ligases ou synthétases (EC 6)
- Classification des enzymes
- Coenzymes
- Vitamines
- Hormones
- Composés inorganiques
- Composés organiques
- Transport membranaire
- Moteurs moléculaires
- Voies de signalisation

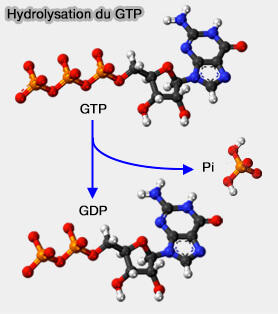
Les GTPases sont une classe d'enzymes qui catalysent l'hydrolyse de la guanosine triphosphate (GTP) en guanosine diphosphate (GDP) et un ion phosphate (Pi).
$\ce{GTP + H2O}$ $\leftrightharpoons$ $\ce{GDP + Phosphate}$
Vue d'ensemble des GTPases
1. Le domaine G, caractéristique de l'ensemble de cette superfamille, est responsable de la fixation du GTP et comportent le pli de la boucle P (ou P-loop)
(Figure : vetopsy.fr)
L'hydrolyse du phosphate γ du GTP en GDP et Pi est due à un mécanisme SN2 (
- qui passe par un état intermédiaire pentavalent,
- qui dépend de l'ion magnésium Mg++.
Dans la plupart des GTPases, le motif responsable de leur spécificité pour les nucléotides guanidiques est la séquence consensus N/TKxD (
2. Certaines, comme les protéines G proprement dites (ou grandes protéines G) forment des complexes hétérotrimériques composés d'une unité α, β, et γ.
Cette catégorie est activée par des récepteurs intramembranaires appelés récepteurs couplés aux protéines G qui font intervenir des seconds messagers.
3. D'autres, comme les petites GTPases, sont appelées ainsi car elle se présentent sous forme monomérique (analogue à la sous-unité α des protéines G).
Les membres de la superfamille de la dynamine (DSP) sont quelquefois appelés grandes GTPases.
Rôles des GTPases
(Figure : vetopsy.fr)
Les fonctions GTPases sont essentielles dans un grand nombre de processus cellulaires :
- la transduction du signal au niveau du domaine intracellulaire des récepteurs transmembranaires, en particulier dans les organes des sens (gustation, olfaction et vision) ;
- la biosynthèse des protéines (traduction) au niveau du ribosome ;
- le contrôle et différenciation lors de la division cellulaire ;
- la translocation des protéines à travers les membranes (
transport membranaire) ;
- le transport des vésicules au sein de la cellule ;
- la fusion et la fission des mitochondries, qui permet leur adaptation rapide aux changements des conditions cellulaires.
Classification des GTPases
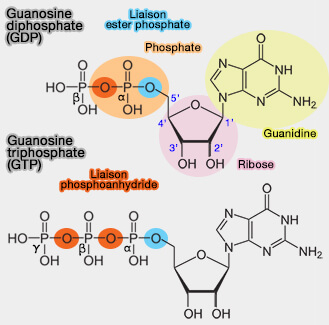
Les GTPases font partie d'une famille plus large des enzymes spécifiques des anhydrides contenant du phosphore (EC 3.6.).
Un anhydride est le produit d'un composé qui a perdu une ou plusieurs molécules d'eau ($\ce{H2O}$) par élimination au cours d'une réaction chimique.
Les GTPases font partie des EC 3.6.5 de la nomenclature internationale des enzymes qui sont des protéines qui lient et hydrolysent les nucléotides triphosphate.
$\ce{GTP + H2O}$ $\leftrightharpoons$ $\ce{GDP + Phosphate}$
1-2. Les protéines G sont composées :
- 1. des grandes protéines G hétérotrimériques (EC 3.6.5.1) impliquées dans le signaux hormonaux et sensoriels, comportant 16 sous-unités α, 5 β et 12 γ différentes selon la protéine.
- 2. des petites GTPases monomériques (EC 3.6.5.2), qui composent la superfamille des Ras (RAs Sarcoma) et sont impliquées dans les cascades de transduction, comportant une cinquantaine de protéines appartenant à différentes sous-familles comme les Ras, Rho (Ras HOmologous), Ran (RAs Nucléaire), Rab et Arf (Adp-Ribosylation Factor).

Les grandes protéines G hétérotrimériques et les petites GTPases monomériques sont traitées dans des chapitres spéciaux.
3. Les facteurs d'élongation (EF), d'initiation (IF) ou de terminaison - peptide-release ou termination factor - (EC 3.6.5.3 : protein-synthesizing GTPases) sont des facteurs de translation impliqués dans la synthèse ribosomale des protéines.
4. Les particules de reconnaissance du signal (EC 3.6.5.4 : signal-recognition-particle GTPases) procèdent à la synthèse des protéines associées au réticulum endoplasmique pour la translocation des peptides.
5. La dynamine (EC 3.6.5.5) et les membres de sa superfamille (
- dans l'endocytose et qui contribue à séparer les vésicules de la membrane, ainsi
- dans la fusion et la fission des mitochondries ou des endosomes.
6. La tubuline (EC 3.6.5.6), responsable de l'activité intrinsèque de l'α-tubuline impliquée dans le repliement de la tubuline, protéine structurale des microtubules, un constituant majeur du cytosquelette et la division cellulaire, i.e. cytokinèse.
Remarque : on peut aussi classer ces GTPases en deux classes.
- Les TRAFAC (TRAlator FACtor) inclut toutes les protéines G, les petites GTPases, la superfamille de la dynamine (grandes GTPases), la superfamille de la myosine/kinésine , les facteurs de translation et les septines.
- Les SIMIBI (after SIgnal recognition particle, MInD and BIoD) class) comprennent les particules de reconnaissance du signal GTPases, MinD and BioD related proteins, ces deux dernières étant des ATPases ne liant pas GTP (Classification and Evolution of P-loop GTPases and Related ATPases 2002).
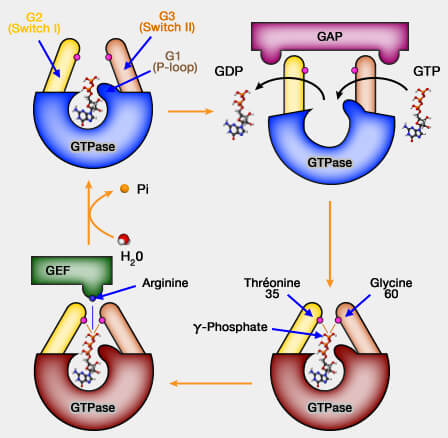
Vue d'ensemble de l'activité GTPasique
1. L'activité GTPasique est régulée par leur capacité à fixer et hydrolyser la GTP en GDP et Pi : ce processus sert de " commutateur ou interrupteur moléculaire " (switch) pour déclencher ou inhiber des réactions biochimiques dans la cellule.
- Liées au GTP, les protéines G sont " on " (sous forme active) par un changement de conformation : elles se fixent sur de nombreuses protéines pour réguler leur fonction.
- Liées au GDP, après hydrolisation du GTP, elles sont " off " (sous forme inactive).

La fixation du GTP est effectuée par un domaine très conservé dans l'évolution, appelé domaine G, caractéristique de l'ensemble de cette superfamille, qui est étudié dans un chapitre spécial.
(Figure : vetopsy.fr)
2. La vitesse de l'hydrolyse du GTP en GDP, qui est relativement lente, dépend de l'activité GTPasique intrinsèque (ou élémentaire) de la GTPase.

En d'autres termes, cette activité GTPasique intrinsèque permet de maintenir le commutateur sur " on ", plus ou moins longtemps, un peu comme un minuteur.
3. En outre, d'autres protéines peuvent réguler la vitesse de ces " commutateurs fonctionnels ", essentiels à la dynamique cellulaire.
- Les GEF (Guanine nucleotide exchange factor) activent l'activité GTPasique (mise en position " on ") en stimulant la libération de guanosine diphosphate (GDP) pour permettre la liaison de guanosine triphosphate (GTP).
- Les GAP (GTPase-Activating Protein ou GTPase-Accelerating Protein) inhibent l'activité GTPasique (mise en position " off ") en accélèrent l'hydrolyse intrinsèquement lente de la GTP.
Les GDI (guanosine nucleotide dissociation inhibitor), une troisième classe de protéines, sont uniquement impliquées dans le fonctionnement des Rho et des Rab.


