Enzymes
Groupe des hydrolases (EC 3)
GTPases : DSP (superfamille de la dynamine)
Dynamine : vue d'ensemble et structure
- Biochimie
- Chimie organique
- Bioénergétique
- Composition de la matière vivante
- Composés organiques
- Protides
- Acides nucléiques
- Glucides
- Lipides
- Enzymes
- Classification des enzymes
- Oxydoréductases (EC 1)
- Transférases (EC 2)
- Hydrolases (EC 3)
- Lyases ou synthases (EC4)
- Isomérases (EC5)
- Ligases ou synthétases (EC 6)
- Classification des enzymes
- Coenzymes
- Vitamines
- Hormones
- Composés inorganiques
- Composés organiques
- Transport membranaire
- Moteurs moléculaires
- Voies de signalisation

La dynamine fait partie de la superfamille de la dynamine (DSP : Dynamin Superfamily Proteins) qui comprend de nombreuses GTPases, de grande taille par rapport aux petites GTPases.
De toutes les DSP, la dynamine, découverte en 1989, première protéine à être impliquée dans les processus de fission, est la plus étudiée !
Vue d'ensemble de la dynamine
La dynamine est une GTPase (EC 3.6.5.5).
(Figure : vetopsy.fr d'après Thottacherry et coll)
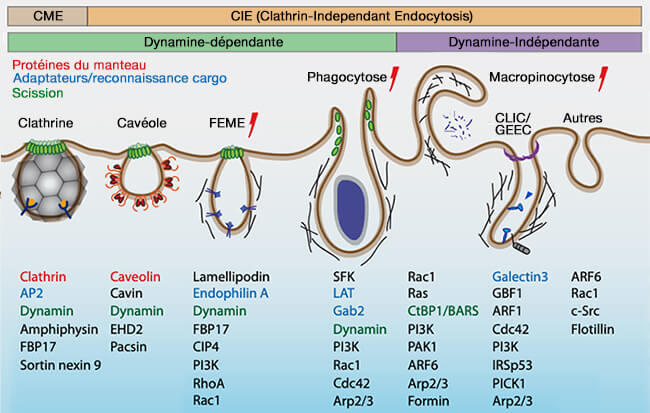
1. La dynamine peut être recrutée par les vésicules d'endocytose pour catalyser leur séparation (" fission " en anglais) de la membrane.
Cette séparation intervient dans à la fin de l'endocytose :
- l'endocytose clathrine-dépendante (CME ou Clathrin-Mediated Endocytosis),
- l'endocytose cavéole-dépendante, quelquefois appelée potocytose),
- l'endocytose rapide endophiline-dépendante (FEME ou Fast Endophilin-Mediated Endocytosis),
- la macropinocytose.

Le détachement de la vésicule de clathrine de la membrane est étudiée dans un chapitre spécial.
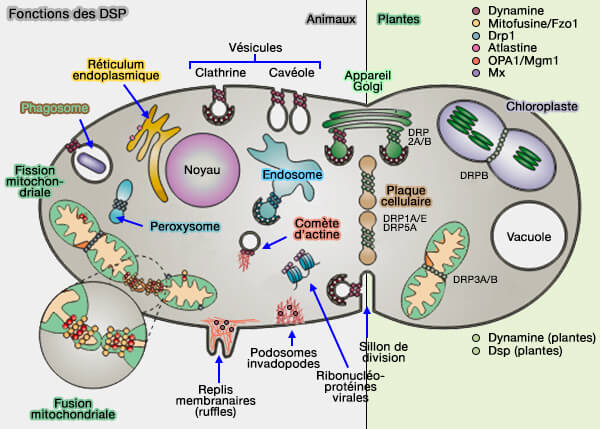
2. La dynamine peut également être associée :
- aux microtubules,
- aux replis membranaires (membrane ruffles),
- aux podosomes,
- aux queues d'actine (actin comet tail), i.e. structures formées par la polymérisation dynamique de l'actine dans les endosomes ou suite aux mouvements de certaines bactéries comme les listeria (Arp2/3-Mediated Actin-Based Motility: A Tail of Pathogen Abuse 2013),
- aux podocytes (cellules épithéliales du glomérule rénal).
3. La dynamine exerce des fonctions variées (Dynamin, a membrane remodelling GTPase 2012).
Elle est co-localisée avec les NPF et le complexe Arp2/3.
(Figure : vetopsy.fr modifiée d'après Praefcke et McMahon)
Isoformes de la dynamine
La dynamine possède trois isoformes chez les mammifères d'environ 80% d'homologie avec de nombreux épissages (Differential Distribution of Dynamin Isoforms in Mammalian Cells 1998 et Early and nonredundant functions of dynamin isoforms in clathrin-mediated endocytosis 2020).
- Les dynamines 1 et 3 sont fortement exprimées dans les neurones dans lesquels la dynamine 1 représente de loin l'isoforme prédominante. La dynamine 3 est aussi présente dans les testicules et d'autres tissus en quantité faible comme les poumons.
- La dynamine 2 est ubiquitaire et omniprésente (Distinct functions of dynamin isoforms in tumorigenesis and their potential as therapeutic targets in cancer 2016).
La conformation tridimensionnelle de la dynamine n'est pas corrélé à sa séquence linéaire (Building a fission machine – structural insights into dynamin assembly and activation 2013).
Structure de la dynamine
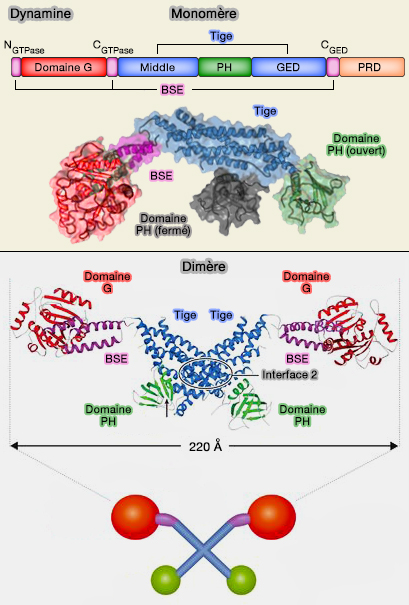
La dynamine est composée de 5 domaines.
Domaine catalytique GTPase
1. Le domaine catalytique GTPase de 300 acides aminés est bien plus grand que celui des petites GTPases (180 acides aminés).
Les membres de la superfamille de la dynamine (DSP) sont quelquefois appelés pour cette raison, grandes GTPases.
(Figure : vetopsy.fr d'après Antonny et coll)
2. Le BSE (Bundle signaling élément) est un faisceau de 3 hélices, composé par les domaines C et N-terminal du domaine G (CGTPase et NGTPase), associé au domaine C-terminal du GED (CGED) .
Le BSE forme une surface hydrophobe étendue et très conservée.
- Il peut pivoter comme un corps rigide autour d'un résidu de proline conservé (P294) qui plie l'hélice de la CGTPase.
- Ce lien entre le domaine G et le BSE est flexible, mais les angles entre ces deux domaines sont contraint par la proline.
Le BSE module l'activité GTPase de la dynamine in vitro et accélère la fission in vivo et pourrait coupler cette activité avec le domaine PH (G domain dimerization controls dynamin's assembly-stimulated GTPase activity 2010)

Le domaine G est étudié dans un chapitre spécial.
Domaine central (Middle
ou MID) ou tige
1. Le domaine central, MID pour middle, domaine coiled-coil (superhélice), forme une tige (" stalk ") avec le domaine GED impliquée :
- dans la conformation monomérique de la dynamine (repliée sur elle-même),
- dans son oligomérisation (dimère et tétramères).
Le bloc de base est un dimère, formé par l'association entrecroisée des tiges à travers l'interface hydrophobe 2 (cf. figure ci-contre du dimère).
(Figure : vetopsy.fr d'après Antonny et coll)
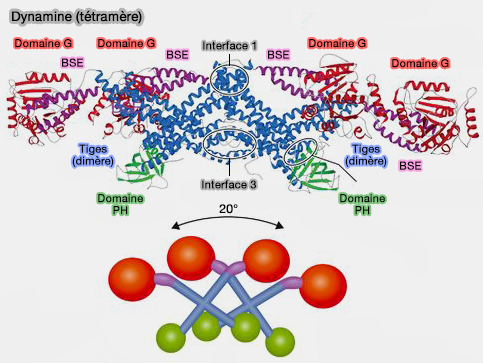
2. Les tiges sont orientées verticalement sur la surface de la membrane.
Elles créent également des interfaces qui participent aux interactions radiales dimères-dimères et assurent l'auto-assemblage hélicoïdal (cf. figure au-dessous du tétramère) :
- l'interface 1 (extrémités distales),
- l'interface 3 (extrémités proximales).
Domaine PH
1. Le domaine PH (Pleckstrin Homology), domaine polarisé d'environ 120 acides aminés, se lie au PI(4,5)P2 ou P2 de la membrane et forme l'anneau interne de la structure hélicoïdale liée à l'auto-assemblage (
Ce domaine, ainsi que le domaine PRD (cf. plus bas), remplace les inserts non structurés des dynamines " anciennes ".
2. Le domaine PH est lié à l'auto-inhibition de la dynamine (
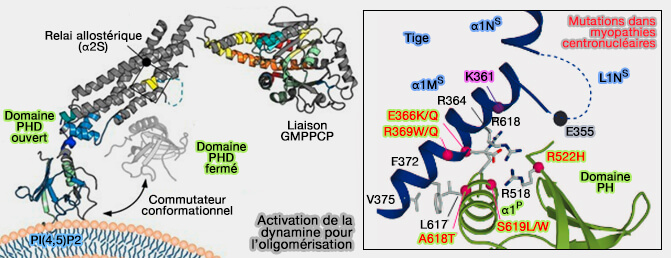
Figure : vetopsy.fr d'après Srinivasan et coll et Reubold et coll)
3. La régulation de l'activité GTPasique est altérée par des mutations dans ce domaine, qui (
- perturbent l'endocytose (Importance of the pleckstrin homology domain of dynamin in clathrin-mediated endocytosis 1999) ;
-
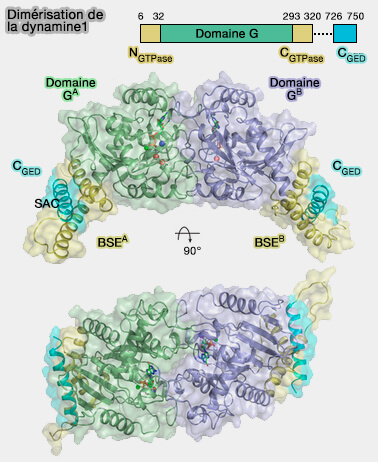
Dimérisation de la dynamine
(Figure : vetopsy.fr d'après Chappie et coll)
Domaine GED
1. Le domaine GED (GTPase Effector Domain) fonctionne :
- comme une GAP (GTPase-Activating Protein ou GTPase-Accelerating Protein) qui, en accélérant l'hydrolyse intrinsèquement lente de la GTP, inhibent l'activité GTPasique (mise en position " off "),
- comme une interface pour l'oligomérisation.
2. Le domaine C-terminal du GED (CGED) forme avec les domaines C et N-terminal du domaine G (CGTPase et NGTPase), le domaine BSE (Bundle signaling élément).
Domaine PRD
Le domaine PRD C-terminal (riche en proline et en arginine) se lie aux domaines SH3 ou aux domaines BAR de nombreuses protéines (
Ce domaine, ainsi que le domaine PH (cf. plus haut), remplace les inserts non structurés des dynamines " anciennes ".


